Électrode au chlorure d'argent
Une électrode au chlorure d'argent est une électrode de référence, couramment utilisée en électrochimie. Elle est par exemple souvent utilisée comme électrode de référence interne dans les électrodes de verre pour la mesure du pH. Pour des raisons environnementales, elle est de plus en plus utilisée en remplacement de l'électrode au calomel saturée ou l'électrode au sulfate mercureux qui contiennent du mercure.
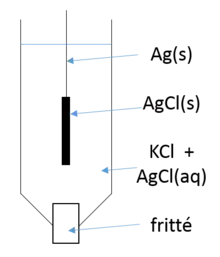
Son potentiel est fixé par l'équilibre rédox entre l'argent métallique (Ag) et les ions Ag+ dont la concentration est fixée par la solubilité du chlorure d'argent (AgCl).
Cet équilibre peut être décrit par la demi-équation suivante :
associé à la solubilité de AgCl :
Ce qui donne finalement :
La relation de Nernst pour cette dernière demi-équation montre la dépendance du potentiel de cette électrode à l'activité des ions chlorures :
Le potentiel standard E0AgCl/Ag par rapport à l'électrode standard à hydrogène (ESH) vaut 0.222 V [1].
Applications
| Electrode | Potentiel E0+Elj | Coef. Temperature. |
|---|---|---|
| (V) à 25 °C | (mV/°C) à environ 25 °C | |
| ESH | 0.000 | 0.000 |
| Ag/AgCl/KCl sat. | +0.197 | -1.01 [réf. nécessaire] |
| Ag/AgCl/3.5 mol/kg KCl | +0.205 | -0.73 |
| Ag/AgCl/3.0 mol/kg KCl | +0.210 | ? |
| Ag/AgCl/1.0 mol/kg KCl | +0.235 | +0.25 [réf. nécessaire] |
| Ag/AgCl/0.6 mol/kg KCl | +0.25 | |
| Ag/AgCl (eau de mer) | +0.266 |
Notes et références
- Lide, David R. et Frederikse, H. P. R., CRC handbook of chemistry and physics : a ready-reference book of chemical and physical data., CRC, , 2576 p. (ISBN 978-0-8493-0597-9, OCLC 35318951, lire en ligne)
- Portail de la chimie