Épichlorohydrine
L'épichlorohydrine ou épichlorhydrine ou 1-chloro-2,3-époxypropane, est un composé organochloré de formule semi-développée CH2CHOCH2Cl, liquide volatil toxique, incolore à forte odeur d'ail. L'épichlorohydrine est chirale car un atome de carbone est stéréogène, il existe donc deux formes énantiomères de ce composé.
| (±)-Épichlorohydrine | |
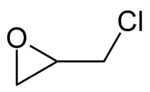
| |
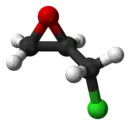 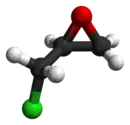 Énantiomère R de l'épichlorohydrine (à gauche) et S-épichlorohydrine (à droite). |
|
| Identification | |
|---|---|
| Nom UICPA | 2-(chlorométhyl)oxirane |
| Synonymes |
1-chloro-2,3-époxypropane, |
| No CAS | (R,S) |
| No ECHA | 100.003.128 |
| No CE | 203-439-8 |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | liquide incolore |
| Propriétés chimiques | |
| Formule | C3H5ClO [Isomères] |
| Masse molaire[1] | 92,524 ± 0,005 g/mol C 38,94 %, H 5,45 %, Cl 38,32 %, O 17,29 %, 92.52 g/mol |
| Propriétés physiques | |
| T° fusion | −48 °C[2] |
| T° ébullition | 116,56 °C[2] |
| Solubilité | 6,59 g/100 ml (eau, 25 °C) ; miscible avec l'alcool, l'éther, le chloroforme, le trichloroéthylène, le tétrachlorure de carbone ; immiscible avec les hydrocarbures de pétrole[3] |
| Paramètre de solubilité δ | 22,5 MPa1/2 (25 °C)[4] |
| Masse volumique | 1,180 66 g cm−3 à 20,0 °C[2] |
| T° d'auto-inflammation | 415,6 °C[2] |
| Point d’éclair | 40,6 °C[2] |
| Pression de vapeur saturante | 1,333 kPa à 16,6 °C[2] |
| Viscosité dynamique | 1,03 mPa s à 25 °C[2] |
| Précautions | |
| SGH[5] | |
     |
|
| SIMDUT[6] | |
   B3, D1A, D2A, E, |
|
| NFPA 704[7] | |
| Transport[5] | |
| Classification du CIRC | |
| Groupe 2A, carcinogène | |
| Inhalation | TLV : 2 ppm[réf. souhaitée] |
| Peau | 7,6 mg/m3[réf. souhaitée] |
| Écotoxicologie | |
| DL50 | 90 mg kg−1 (rat, oral) 154 mg kg−1 (rat, i.v.) 150 mg kg−1 (rat, s.c.) 113 mg kg−1 (rat, i.p.)[8] |
| LogP | 0,45[8] |
| Seuil de l’odorat | bas : 0,93 ppm[réf. souhaitée] |
| Unités du SI et CNTP, sauf indication contraire. | |
Malgré son nom, l'épichlorohydrine n'appartient pas à la famille des chlorohydrines, puisqu'elle n'est pas un alcool halogéné, mais un époxyde. Certains intermédiaires directs de sa synthèse, tels le 2,3-dichloro-1-propnol et le 1,3-dichloro-2-propnol, sont eux en revanche des chlorohydrines.
Production
L'épichlorohydrine est fabriquée à partir de chlorure d'allyle en deux étapes, d'abord, une hydrochloration utilisant l'acide hypochloreux, donnant un mélange de chlorohydrines :
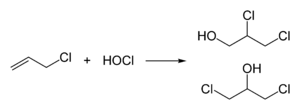
La deuxième phase aboutit à la formation de l'époxyde par traitement avec une base :
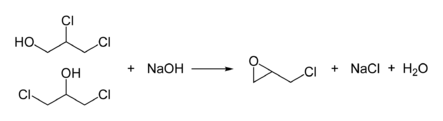
Par cette voie, plus 800 000 tonnes (1997) d'épichlorohydrine sont produites annuellement[9].
Voie du glycérol
L'épichlorohydrine fut décrite pour la première fois en 1848 par Marcellin Berthelot. Le composé fut isolé durant des études sur les réactions entre le glycérol et le chlorure d'hydrogène gazeux[10].
Rappelant l'expérience de Berthelot, des usines de glycérol-épichlorhydrine (GTE, pour glycerol-to-epichlorohydrin) ont été commercialisées. Cette technologie tire parti de la disponibilité de glycérols bon marché provenant de la transformation des biocarburants[11]. Dans le procédé mis au point par Dow Chemical, le glycérol subit deux réactions de substitution lorsqu'il est traité avec du chlorure d'hydrogène en présence d'un acide carboxylique utilisé comme catalyseur. La réaction forme l'un des deux mêmes intermédiaires que dans le procédé chlorure d'allyle/acide hypochloreux, le 1,3-dichloro-2-propnol, et il est également traité avec une base pour former de l'épichlorhydrine[12].
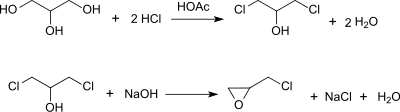
Autres voies
D'autres voies impliquant moins d'intermédiaires chlorés continuent à être explorées. On peut citer par exemple l'époxydation du chlorure d'allyle[13].
Utilisation
Synthèse de glycérol et de résines époxyde
L'épichlorohydrine est principalement convertie en éther diglycidique du bisphénol A (en), un élément de base dans la fabrication des résines époxyde[14]. Elle est également un précurseur de monomères pour d'autres résines et polymères, notamment des résines échangeuses d'ions, des polyétherpolyols pour des mousses polyuréthane ignifugées, des alkylglycéryléthersulfonates pour des détergents, des élastomères (codes de polymère CO, ECO), et des résines spéciales pour le traitement du papier[15].
Un autre usage est la conversion en glycérol synthétique. Cependant, l'augmentation rapide de la production de biodiesel, où le glycérol est un déchet, a entraîné une surabondance de glycérol sur le marché, rendant ce procédé non rentable. Le glycérol synthétique n'est désormais utilisé que dans des applications pharmaceutiques et biotechnologiques sensibles où les normes de qualité sont très élevées[16].
Applications mineures et de niche
L'épichlorhydrine est un précurseur polyvalent dans la synthèse de nombreux composés organiques. Par exemple, elle peut être convertie en nitrate de glycidyle, un liant énergétique utilisé dans les compositions explosives et propulsives[17]. L'épichlorhydrine est mise à réagir avec un nitrate alcalin, tel que le nitrate de sodium, produisant du nitrate de glycidyle et un chlorure alcalin. Elle est utilisée comme solvant pour la cellulose, les résines et les peintures, et elle a trouvé une utilisation comme fumigant contre les insectes[18].
Les polymères fabriqués à partir d'épichlorhydrine, par exemple les résines polyamide-épichlorhydrine, sont utilisés dans le renforcement du papier et dans l'industrie alimentaire pour fabriquer des sachets de thé, des filtres à café et des boyaux synthétiques pour saucisses/saucissons, ainsi que pour la purification de l'eau[19].
Une application biochimique importante de l'épichlorhydrine est son utilisation comme agent de réticulation pour la production de résines de chromatographie d'exclusion stérique en Sephadex (en) à partir de dextrane[20].
Sécurité
L'épichlorhydrine est classée par plusieurs agences et groupes internationaux de recherche en santé comme un agent cancérigène probable chez l'homme[21],[22],[23]. La consommation (orale) prolongée de niveaux élevés d'épichlorhydrine pourrait entraîner des problèmes d'estomac et un risque accru de cancer[24]. L'exposition professionnelle à l'épichlorhydrine par inhalation pourrait entraîner une irritation des poumons et un risque accru de cancer du poumon[25].
L'épichlorhydrine est inflammable, formant des produits de décomposition dangereux en cas de feu. Elle est toxique par inhalation, par contact avec la peau et par ingestion, et peut provoquer des brûlures. Elle peut entraîner une sensibilisation par contact avec la peau.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Epichlorohydrin » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Guenter Sienel, Robert Rieth et Kenneth T. Rowbottom, Epoxides, Wiley-VCH Verlag, coll. « Ullmann's Encyclopedia of Industrial Chemistry », (DOI 10.1002/14356007.a09_531, présentation en ligne).
- « EPICHLOROHYDRIN » dans la base de données Hazardous Substances Data Bank (consulté le 16 juillet 2012).
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294.
- Entrée « Epichlorhydrin » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 3 décembre 2010 (JavaScript nécessaire).
- « Épichlorohydrine » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 3 décembre 2010.
- UCB Université du Colorado
- (en) « Épichlorohydrine », sur ChemIDplus (consulté le 3 décembre 2010).
- Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, (DOI 10.1002/14356007.a01_425).
- Marcellin Berthelot, « Sur les combinaisons de la glycérine avec les acides et sur la synthèse des principes immédiats des graisses animaux », Ann. Chim. Phys., vol. 41, , p. 216–319 (lire en ligne [archive du ], consulté le ).
- Doris de Guzman, « Growing glycerine-to-ECH plants », ICIS Green Chemicals, .
- Bruce M. Bell, John R. Briggs, Robert M. Campbell, Susanne M. Chambers, Phil D. Gaarenstroom, Jeffrey G. Hippler, Bruce D. Hook, Kenneth Kearns, John M. Kenney, William J. Kruper, D. James Schreck, Curt N. Theriault et Charles P. Wolfe, « Glycerin as a Renewable Feedstock for Epichlorohydrin Production. The GTE Process », CLEAN - Soil, Air, Water, vol. 36, no 8, , p. 657 (DOI 10.1002/clen.200800067, lire en ligne [archive du ] [full text reprint], consulté le ).
- Jun Li, Gongda Zhao, Shuang Gao, Ying Lv, Jian Li et Zuwei Xi, « Epoxidation of Allyl Chloride to Epichlorohydrin by a Reversible Supported Catalyst with H2O2 under Solvent-Free Conditions », Org. Process Res. Dev., vol. 10, no 5, , p. 876–880 (DOI 10.1021/op060108k).
- Ha Q. Pham et Maurice J. Marks, « Epoxy Resins », Wiley-VCH, Weinheim, (ISBN 978-3527306732, DOI 10.1002/14356007.a09_547.pub2).
- « Seuils de Toxicité aiguë - Epichlorhydrine », INERIS.
- Phil Taylor, « Synthetic glycerine is back (but never really went away)! », sur In-Pharma Technologist, (consulté le ).
- Gould, R.F., Advanced Propellant Chemistry, ACS Chemistry Series 54, 1966.
- « Suburban Water Testing Labs:Epichlorohydrin Fact Sheet » [archive du ], H2otest.com (consulté le ).
- « Government of Canada Chemical Substances: Oxirane,(chloromethyl)-(Epichlorohydrin) CAS Registry Number 106-89-8 » (consulté le ).
- « GE Healthcare Life Sciences - Instructions for Sephadex Media » [archive du ], sur gelifesciences.com (consulté le ).
- « EPA Integrated Risk Information System: Epichlorohydrin (CASRN 106-89-8) » (consulté le ).
- « Government of Canada: Screening Assessment for Epichlorohydrin » (consulté le ).
- « NIOSH Pocket Guide to Chemical Hazards - Epichlorohydrin » (consulté le ).
- « Basic Information about Epichlorohydrin in Drinking Water » (consulté le ).
- « Government of Canada: Screening Assessment for Epichlorohydrin » (consulté le ).


