Équation de Cottrell
L'équation de Cottrell (du nom de l'Américain Frederick Gardner Cottrell) concerne les techniques d'électrochimie transitoire. Elle montre que, lorsqu'un saut de potentiel est imposé à une électrode, le courant électrique décroît selon l'inverse de la racine carrée du temps.
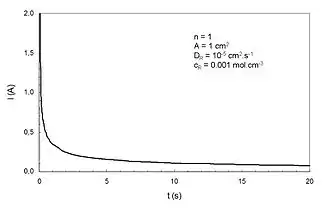
Dans le cas d'une réaction d'oxydo-réduction du type R → O + ne−, où R est le réducteur et O l'oxydant d'un couple rédox, l'équation de Cottrell s'écrit :
Avec :
- I : courant (A) ;
- t : temps (s) ;
- n : nombre d'électrons échangés (mol) ;
- F : constante de Faraday (96485 C.mol-1) ;
- A : surface de l'électrode (cm2) ;
- cR : concentration interfaciale de R (mol.cm-3) ;
- DR : coefficient de diffusion de R (cm2.s-1) .
Conditions de validité
L'équation de Cottrell est établie dans le cas d'une réaction rédox réversible (c'est-à-dire une réaction dont la cinétique est très rapide et dont le courant est contrôlé par la diffusion), dans l'hypothèse d'une diffusion linéaire semi-infinie et perpendiculaire à la surface de l'électrode. Le potentiel d'équilibre est tel que la concentration initiale en espèce O est négligeable. Seul un réactif est présent en solution à l'équilibre, et il est complètement oxydé à la suite de l'application du saut de potentiel.
Références
- Hubert H. Girault, Électrochimie physique et analytique, Éd. Presses Polytechniques et Universitaires Romandes, 2001 (ISBN 2-88074-429-6)
- Portail de la chimie