Équation de Kelvin
L'équation de Kelvin est basée sur la formule de la pression de Laplace et s'applique à un fluide en équilibre avec sa vapeur[1]. Si on suppose que l'interface liquide-vapeur a un rayon de courbure moyen , elle permet de relier la pression de vapeur avec ce rayon de courbure :
dans laquelle est la pression de vapeur saturante, est la tension de surface, est le volume molaire du liquide, est la Constante universelle des gaz parfaits et est la température.
Il faut faire attention à la convention utilisée pour définir le rayon de courbure : on suppose dans cette équation que si la surface est convexe (observée depuis la phase gazeuse), est positif. Si la surface est concave, est négatif. Nous concluons donc que :
- Si l'interface est convexe : ;
- Si l'interface est concave : .
Avec une convention différente, certains auteurs présentent cette équation avec un signe négatif [2].
Cette équation permet de prévoir la condensation capillaire dans la porosité d'un solide en fonction de la taille des pores. Pour une pression donnée, est donc le rayon de pore le plus grand dans lequel la condensation capillaire peut se produire, on appelle cette limite rayon de Kelvin. On peut ainsi calculer l'adsorption d'humidité dans un matériau alvéolaire en fonction de l'hygrométrie de l'air, ou la condensation d'un hydrocarbure dans un adsorbant poreux.
L'équation de Kelvin est aussi utilisée pour la détermination de la taille des pores à partir de la mesure d'un isotherme d'adsorption par la méthode BJH (méthode de Barrett, Joyner et Halenda [3]).
Démonstration
Supposons que l'on ait un liquide en contact avec sa vapeur selon une interface dont la courbure moyenne est . Si on prend le cas où la surface du liquide forme un ménisque concave comme sur le schéma ci-contre, alors ce rayon est négatif. La loi de Laplace-Young indique que la pression dans le gaz et celle dans le liquide sont reliées :

Supposons que l'on étudie un liquide pur en équilibre avec sa vapeur, cet équilibre correspond à une égalité des potentiels chimiques du gaz et de la vapeur [2],[4]. Supposons que l'on déplace légèrement cet équilibre vers un nouvel équilibre, on peut écrire pour le nouvel équilibre , par conséquent . Si la température est constante, cette variation de potentiel chimique est:
.
et sont respectivement les volumes molaires du liquide et du gaz. La dérivation de l'équation de Laplace à température constante donne:
En combinant ces deux équations, nous pouvons éliminer :
Le volume molaire du liquide étant 1000 fois plus petit que celui du gaz, on peut simplifier cette équation :
En supposant que la vapeur est un gaz parfait :
On sait que la pression au-dessus d'une surface liquide plane est , nous pouvons donc intégrer cette équation :
Ce qui donne l'équation de Kelvin :
Donc dans le cas étudié ici, puisque , il est donc possible de condenser le liquide dans la porosité d'un matériau à une pression inférieure à la pression de vapeur saturante si le liquide est mouillant pour la surface.
Exemple
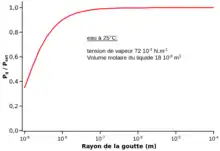
Supposons que l'on veuille condenser de l'eau à l'aide d'un solide poreux, l'eau étant un liquide mouillant pour la surface de ce matériau. L'équation de Kelvin permet de calculer le rapport , c'est-à-dire l'humidité relative, pour laquelle on observera une condensation en fonction de la taille des pores du matériau.
Dans l'exemple ci-contre, avec un matériau ayant une taille de pore nanométrique, on peut atteindre une hydrométrie relative de 30 % avec un matériau ayant des pores de taille nanométrique ().
Références
- W. Thomson "On the equilibrium of vapour at a curved surface of liquid" Philosophical Magazine, séries 4, 42 (282), pages 448–452 (1871)
- K. S. W. Sing, F. Rouquerol, J. Rouquerol, P. Llewellyn "Adsorption by powders and porous solids" 2e édition, chapitre 8 "Assessment of mesoporosity" Academic Press (2014)
- E. P. Barrett, L. G. Joyner, P. H. Halenda "The determination of pore volume and area distributions in porous substrances. 1. Computations from nitrogen isotherms" Journal of the American Chemical Society, vol 73(1), pages 373-380 (1951)
- R. Defay, I. Prigogine, Tension superficielle et adsorption, Dunod (1951)
- Portail de la physique