Équation de Starling
L' équation de Starling décrit le flux net de fluide à travers une membrane semi-perméable[1]. Elle porte le nom d'Ernest Starling[2]. Elle décrit l'équilibre entre la pression capillaire, la pression interstitielle et la pression osmotique[3],[4]. L'équation classique de Starling a ensuite été révisée. Le principe de Starling sur l'échange des fluides est essentiel pour comprendre comment le fluide plasmatique (solvant) de la circulation sanguine (liquide intravasculaire) se déplace à travers l'endothélium vers l'espace extérieur aux vaisseaux (espace extravasculaire)[5].
L'échange de fluide trans-endothélial se produit principalement dans les capillaires et est analogue à un processus d'ultrafiltration du plasma à travers une membrane semi-perméable. L'equation de Starling attribue le rôle de la membrane ultrafiltrante au glycocalyx de la membrane plasmique des cellules endothéliales, dont les espaces entre polymères fonctionnent comme un système de petits pores, de rayon environ 5 nm. Lorsque le glycocalyx endothélial recouvre une fente intercellulaire endothéliale, l'ultrafiltrat plasmatique peut passer dans l'espace interstitiel. Certains capillaires continus peuvent comporter des fenestrations qui fournissent une voie sous-glycocalyx supplémentaire pour le solvant et les petits solutés. Les capillaires discontinus que l'on trouve dans les tissus sinusoïdaux de la moelle osseuse, du foie et de la rate ont une fonction de filtrage très voire totalement réduite[6].
La vitesse à laquelle le liquide est filtré à travers l'endothélium vasculaire (filtration transendothéliale) est déterminée par la somme de deux actions extérieures : la pression capillaire () et la pression osmotique des protéines interstitielles (), et deux forces d'absorption; la pression osmotique des protéines plasmatiques () et la pression interstitielle (). L'équation de Starling décrit comment cet équilibre de pression régit la vitesse du fluide à travers l'endothélium. C'est l'une des équations de Kedem-Katchalski qui apporte la thermodynamique non stationnaire à la théorie de la pression osmotique à travers les membranes qui sont au moins partiellement perméables au soluté responsable de la différence de pression osmotique[7],[8]. La deuxième équation de Kedem-Katchalsky explique le transport trans endothélial des solutés, .
L'équation
L'équation classique de Starling est la suivante[9] :
avec :
- le débit volumique de filtration trans-endothéliale du solvant (unités SI de m3·s -1 ).
- le différentiel de pression net total (unités SI de Pa = kg·m−1·s−2, souvent exprimé en mmHg),
- la pression hydrostatique dans le capillaire
- la pression hydrostatique interstitielle
- la pression oncotique des protéines plasmatiques
- la pression oncotique interstitielle
- le coefficient de réflexion de Staverman (adimensionnel)
- la conductivité hydraulique de la membrane (unités SI de m2·s·kg−1, équivalent à m·s −1·mmHg −1 )
- la surface de filtration (unités SI de m2 )
On définit le produit · comme le coefficient de filtration (unités SI de m4·s·kg−1, ou de manière équivalente en m3·s−1·mmHg−1). L'équation de Starling donne donc une forme linéaire entre la différence de pression totale régnant entre le compartiment vasculaire et l'interstitium d'une part, et le débit volumique à travers la paroi de l'autre, avec comme constante de proportionnalité le coefficient de filtration qui agrège la surface de l'endothélium et sa conductivité. Cette forme est retrouvée dans la loi de Darcy, qui exprime le débit d'un fluide filtrant à travers un milieu poreux. Dans la loi de Darcy cependant, le terme de pression concerne uniquement les pressions hydrostatiques, et les effets de la gravité et de la viscosité du fluide sont pris en compte.
Par convention, la pression vers l'interstitium est définie comme positive et la pression vers le capillaire est définie comme négative, de sorte que Jv est positif quand le solvant sort du capillaire (filtration), et négatif quand le solvant pénètre dans le capillaire (absorption).
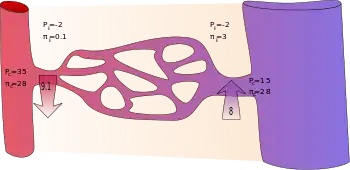
En appliquant l'équation classique de Starling, on a longtemps enseigné que les capillaires continus filtrent le liquide dans leur section artériolaire et en réabsorbent la majeure partie dans leur section veinulaire, comme le montre le diagramme[10].
Cependant, des preuves empiriques montrent que, dans la plupart des tissus, le flux du fluide intraluminal des capillaires est continu et consiste principalement en une filtration (effluent) vers l'interstitium. Cet efflux se produit sur toute la longueur d'un capillaire. Le liquide filtré vers l'espace à l'extérieur d'un capillaire est alors principalement renvoyé à la circulation par le système lymphatique et le canal thoracique[11].
Un mécanisme de ce phénomène est le modèle de Michel-Weinbaum, en l'honneur de deux scientifiques qui, indépendamment, ont décrit la fonction de filtration du glycocalyx. En bref, l'effet de la pression osmotique colloïdale du liquide interstitiel sur s'est avérée très mineur. La différence de pression osmotique colloïdale qui s'oppose à la filtration est maintenant connue comme étant , (avec la pression oncotique liée au subglycocalix) qui a typiquement une valeur très faible. Pourtant, il y a dans des conditions normales une filtration suffisante pour éliminer les protéines interstitielles de la fente interendothéliale. Par conséquent, les valeurs de ainsi calculées sont beaucoup plus faibles. Quand le débit volumique de filtration baisse, les protéines interstitielles diffusent librement vers l'espace sous-glycocalix, ce qui efface la différence de pression osmotique colloïde nécessaire à la réabsorption du fluide vers le capillaire[9].
L'équation révisée de Starling est compatible avec le principe de Starling en régime stationnaire:
avec :
- le débit volumique de filtration trans-endothéliale du solvant (unités SI de m3·s -1 ).
- est la pression motrice nette (unités SI de Pa = kg·m−1·s−2, souvent exprimée en mmHg),
- la pression hydrostatique dans le capillaire
- la pression hydrostatique interstitielle
- la pression oncotique des protéines plasmatiques
- la pression oncotique du sous-glycocalix
- le coefficient de réflexion de Staverman (adimensionnel)
- la conductivité hydraulique de la membrane (unités SI de m2·s·kg−1, équivalent à m·s −1·mmHg −1 )
- la surface de filtration (unités SI de m2 )
Les pressions sont souvent mesurées en millimètres de mercure (mmHg) et le coefficient de filtration en millilitres par minute par millimètre de mercure (ml·min -1·mmHg-1).
Coefficient de filtration
Dans certains textes, le produit de la conductivité hydraulique et de la surface est agrégé en un coefficient de filtration représentant la constante de proportionnalité entre flux et différentiel de pression.[réf. nécessaire]
Coefficient de réflexion
Le coefficient de réflexion de Staverman, σ est une constante sans unité qui est spécifique à la perméabilité d'une membrane pour un soluté donné[12]. On peut généraliser le coefficient de réflexion à tout soluté , en introduisant comme la perméabilité partielle d'une membrane semi-perméable à ce soluté [13]. Dans tous les cas, varie de 0 (membrane totalement perméable; flux uniquement dicté par le différentiel des pressions hydrostatiques) à 1 (membrane totalement imperméable; toutes les particules sont réfléchies contre la membrane).
L'équation de Starling, écrite sans (i.e. = 1) décrit l'écoulement d'un solvant à travers une membrane qui est imperméable aux solutés contenus dans la solution[13].
Lorsque σ est proche de 1, la membrane est moins perméable au soluté considéré (par exemple, des molécules plus grandes telles que l'albumine et d'autres protéines du plasma). Celui-ci peut circuler à travers la paroi endothéliale, de haut en bas le long du gradient de concentration, plus lentement, tout en permettant à l'eau et aux plus petits solutés de traverser le filtre de glycocalyx jusqu'à l'espace extravasculaire[14].
- Les capillaires trouvés dans les glomérules ont un coefficient de réflexion proche de 1 car normalement aucune protéine ne traverse le filtrat glomérulaire.
- En revanche, les sinusoïdes hépatiques ont un coefficient de réflexion proche de zéro car ils sont totalement perméables aux protéines. Le liquide interstitiel hépatique dans l'espace de Disse a la même pression osmotique colloïde que le plasma et la synthèse hépatocytaire de l'albumine peut donc être régulée. L'albumine et d'autres protéines de l'espace interstitiel retournent dans la circulation via la lymphe[15].
Valeurs approximatives
Voici les valeurs généralement utilisées pour les variables de l'équation classique de Starling :
| Emplacement | (mmHg) [16] | (mmHg) [16] | (mmHg) [16] | (mmHg) [16] |
|---|---|---|---|---|
| extrémité artériolaire du capillaire | +35 | -2 | +28 | +0.1 |
| extrémité veinulaire du capillaire | +15 | -2 | +28 | +3 |
On suppose que de l'albumine s'échappe des capillaires et pénètre dans le liquide interstitiel où elle produirait un débit d'eau équivalent à celui produit par une pression hydrostatique de +3 mmHg. Ainsi, la différence de concentration en protéines produirait un écoulement de liquide dans le vaisseau à l'extrémité veineuse équivalent à 28 − 3 = 25 mmHg de pression hydrostatique. La pression oncotique totale présente à l'extrémité veineuse peut être considérée comme +25 mmHg.[réf. nécessaire]
Au début (extrémité artériolaire) d'un capillaire, il existe une pression motrice nette ( ) vers l'extérieur du capillaire de +9.1 mmHg. À son extrémité veinulaire, la pression motrice nette est de -8 mmHg.[réf. nécessaire]
En supposant que la force motrice nette diminue linéairement le long du capillaire, la pression motrice nette moyenne est dirigée vers l'extérieur du capillaire dans son ensemble, ce qui a également pour résultat que plus de fluide sort d'un capillaire qu'il n'y rentre. C'est alors le système lymphatique qui draine l'excès résultant.[réf. nécessaire]
J. Rodney Levick soutient dans son manuel que la pression interstitielle est souvent sous-estimée, et les mesures qui y sont utilisées pour remplir l'équation révisée de Starling montrent que les forces d'absorption sont systématiquement inférieures aux pressions capillaires ou veinulaires.
Organes spécifiques
Reins
Les capillaires glomérulaires ont une couche continue de glycocalyx en condition normale, et le taux de filtration transendothélial total () de solvant vers les tubules rénaux est normalement d'environ 125 ml/min (environ 180 litres/jour). Le des capillaires glomérulaires est plus connu sous le nom de débit de filtration glomérulaire (DFG). Sa valeur est exceptionnellement élevée par rapport à celle trouvée dans le reste du corps, où est typiquement de l'ordre de 5 ml/min (environ 8 litres/jour), et le liquide est renvoyé dans la circulation via les lymphatiques afférents et efférents.[réf. nécessaire]
Poumons
L'équation de Starling peut aussi décrire le mouvement du fluide depuis les capillaires pulmonaires vers l'espace aérien alvéolaire[3],[5].
Tumeurs
Les modifications de vascularisation dans les tumeurs entrainent également de larges modifications du comportement du débit à travers les parois des vaisseaux, notamment via une augmentation de la pression interstitielle[17].
Pertinence clinique
Les principes qui sous-tendent l'équation sont utiles pour expliquer les phénomènes physiologiques dans les capillaires, tels que la formation d'œdème[3],[4].
Woodcock et Woodcock ont montré en 2012 que l'équation révisée de Starling (principe de Starling à l'état stationnaire) fournit des explications scientifiques aux observations cliniques concernant la thérapie par fluide intraveineux[18].
Histoire
L'équation de Starling porte le nom du physiologiste britannique Ernest Starling, qui est également reconnu pour la loi Frank-Starling du cœur[19]. On peut attribuer à Starling d'avoir identifié que « l'absorption des solutions salines isotoniques (de l'espace extravasculaire) par les vaisseaux sanguins est déterminée par cette pression osmotique des protéines sériques » en 1896[2].
Voir également
Références
- (en) M.A. Matthay et T.E. Quinn, « PULMONARY EDEMA », dans Encyclopedia of Respiratory Medicine, Elsevier, (ISBN 978-0-12-370879-3, DOI 10.1016/b0-12-370879-6/00509-3, lire en ligne), p. 544–550
- (en) Starling, « On the Absorption of Fluids from the Connective Tissue Spaces », The Journal of Physiology, vol. 19, no 4, , p. 312–326 (PMID 16992325, PMCID 1512609, DOI 10.1113/jphysiol.1896.sp000596)
- (en) Pramod K. Pal et Robert Chen, « Breathing and the Nervous System », dans Aminoff's Neurology and General Medicine, Elsevier, (ISBN 978-0-12-407710-2, DOI 10.1016/b978-0-12-407710-2.00001-1, lire en ligne), p. 3–23
- (en) Richard L. Kradin, « Sundry Disorders », dans Understanding Pulmonary Pathology, Elsevier, (ISBN 978-0-12-801304-5, DOI 10.1016/b978-0-12-801304-5.00014-9, lire en ligne), p. 297–308
- (en) A.S. Nadon et E.P. Schmidt, « Pathobiology of the Acute Respiratory Distress Syndrome », dans Pathobiology of Human Disease, Elsevier, (ISBN 978-0-12-386457-4, DOI 10.1016/b978-0-12-386456-7.05309-0, lire en ligne), p. 2665–2676
- J Levick, Introduction to Cardiovascular Physiology. 5th edition, London, Hodder Arnold, (ISBN 978-0340-942-048), p. 190
- (en) Staverman, « The theory of measurement of osmotic pressure », Recueil des Travaux Chimiques des Pays-Bas, vol. 70, no 4, , p. 344–352 (ISSN 0165-0513, DOI 10.1002/recl.19510700409, lire en ligne)
- (en) Kedem et Katchalsky, « Thermodynamic analysis of the permeability of biological membranes to non-electrolytes », Biochimica et Biophysica Acta, vol. 27, no 2, , p. 229–246 (ISSN 0006-3002, PMID 13522722, DOI 10.1016/0006-3002(58)90330-5, lire en ligne)
- Levick, « Revision of the Starling principle: new views of tissue fluid balance », The Journal of Physiology, vol. 557, no Pt 3, , p. 704 (ISSN 0022-3751, PMID 15131237, PMCID 1665155, DOI 10.1113/jphysiol.2004.066118)
- Levick, « Revision of the Starling principle: new views of tissue fluid balance », The Journal of Physiology, vol. 557, no Pt 3, , p. 704 (ISSN 0022-3751, PMID 15131237, PMCID 1665155, DOI 10.1113/jphysiol.2004.066118)
- Levick et Michel, C.C., « Microvascular fluid exchange and the revised Starling principle. », Cardiovasc Res, vol. 87, no 2, , p. 198–210 (PMID 20200043, DOI 10.1093/cvr/cvq062)
- (en) Zelman, « Membrane Permeability: Generalization of the Reflection Coefficient Method of Describing Volume and Solute Flows », Biophysical Journal, vol. 12, no 4, , p. 414–419 (ISSN 0006-3495, PMID 5019478, PMCID 1484119, DOI 10.1016/S0006-3495(72)86093-4, Bibcode 1972BpJ....12..414Z)
- (en) Michel, Woodcock et Curry, « Understanding and extending the Starling principle », Acta Anaesthesiologica Scandinavica, vol. 64, no 8, , p. 1032–1037 (ISSN 1399-6576, PMID 32270491, DOI 10.1111/aas.13603)
- (en) Michel, Woodcock et Curry, « Understanding and extending the Starling principle », Acta Anaesthesiologica Scandinavica, vol. 64, no 8, , p. 1032–1037 (ISSN 1399-6576, PMID 32270491, DOI 10.1111/aas.13603)
- W. Wayne Lautt, Fluid Exchange, Morgan & Claypool Life Sciences, (lire en ligne)
- Boron, Walter F., Medical Physiology: A Cellular And Molecular Approaoch, Elsevier/Saunders, (ISBN 978-1-4160-2328-9)
- (en) Laurence T. Baxter et Rakesh K. Jain, « Transport of fluid and macromolecules in tumors. I. Role of interstitial pressure and convection », Microvascular Research, vol. 37, no 1, , p. 77–104 (DOI 10.1016/0026-2862(89)90074-5, lire en ligne, consulté le )
- Woodcock et Woodcock, T. M., « Revised Starling equation and the glycocalyx model of transvascular fluid exchange: an improved paradigm for prescribing intravenous fluid therapy », British Journal of Anaesthesia, vol. 108, no 3, , p. 384–394 (PMID 22290457, DOI 10.1093/bja/aer515)
- (en) Starling, « On the Absorption of Fluids from the Connective Tissue Spaces », The Journal of Physiology, vol. 19, no 4, , p. 312–326 (PMID 16992325, PMCID 1512609, DOI 10.1113/jphysiol.1896.sp000596)
Liens externes
- (en) Derangedphysiology.com : Principe de Starling de la dynamique des fluides transvasculaires : Starling forces and fluid exchange in the microcirculation
- Portail de la physique
- Portail de la physiologie