1,1,2-Trichloro-1,2,2-trifluoroéthane
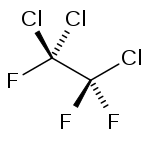
Le 1,1,2-trichloro-1,2,2-trifluoroéthane, souvent appelé plus simplement trichlorotrifluoroéthane, ou encore CFC-113 ou R-113, est un halogénoalcane de la famille des chlorofluorocarbures (CFC) de formule Cl2FC-CClF2. Il se présente sous la forme d'un liquide incolore et très volatil.
| 1,1,2-Trichloro-1,2,2-trifluoroéthane | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 1,1,2-trichloro-1,2,2-trifluoroéthane | |
| Synonymes |
trichlorotrifluoroéthane |
|
| No CAS | ||
| No ECHA | 100.000.852 | |
| No CE | 200-936-1 | |
| Apparence | liquide incolore, volatil, à l'odeur douce | |
| Propriétés chimiques | ||
| Formule | C2Cl3F3 [Isomères] |
|
| Masse molaire[1] | 187,376 ± 0,008 g/mol C 12,82 %, Cl 56,76 %, F 30,42 %, |
|
| Propriétés physiques | ||
| T° fusion | −35 °C[2] | |
| T° ébullition | 48 °C[2] | |
| Solubilité | 0,17 g·l à 20 °C[2] | |
| Paramètre de solubilité δ | 7,1 cal1/2·cm-3/2 (25 °C)[3] | |
| Masse volumique | 1,58 g·cm-3 à 20 °C[2] | |
| T° d'auto-inflammation | 680 °C[2] | |
| Point d’éclair | 195 °C[2] | |
| Pression de vapeur saturante | 364 mbar à 20 °C 539 mbar à 30 °C 1 094 mbar à 50 °C[2] |
|
| Précautions | ||
| Directive 67/548/EEC | ||
 N |
||
| Transport | ||
| Écotoxicologie | ||
| Seuil de l’odorat | bas : 45 ppm haut : 70 ppm[4] |
|
| Composés apparentés | ||
| Isomère(s) | 1,1,1-trichloro-2,2,2-trifluoroéthane | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Le CFC-113 est un chlorofluorocarbure très peu réactif, qui peut rester longtemps dans l'atmosphère s'il y est relâché. Dans la stratosphère, le CF3-113 peut être scindé par les ultraviolets, formant ainsi le radical chlore. Ce dernier peut réagir avec les molécules d'ozone pour former de l'oxygène moléculaire, conduisant à l'appauvrissement global de l'ozone stratosphérique. La quantité de CFC-113 reste relativement stable, d'environ 80 ppt depuis les années 1990[5].
Historique
Le CF3-113 était à l'origine utilisé en tant que liquide de refroidissement dans les climatiseurs et réfrigérateurs, en raison de son bas point d'ébullition et de sa relative inertie. Le CF3-113 était également utilisé comme solvant de nettoyage de composants électroniques, en particulier les téléphones. On estime qu'en 1988, 425 millions d'euros de CF3-113 avaient été utilisés, ce qui représente 17 % du montant total des chlorofluorocarbones produites dans le monde[6]. Le Protocole de Montréal en 1987, a appelé à l'élimination de toutes les CFC, y compris les CFC-113 d'ici à 2010.
Structure chimique
Le CFC-113 a deux isomères constitutionnels : le 1,1,1-trichlorotrifluoroéthane et le 1,1,2-trichlorofluoroéthane. Le premier isomère possède tous les atomes de chlore attachés sur un carbone, et les 3 atomes de fluor portés par l'autre carbone. Le second isomère possède deux chlores et un fluor sur un carbone, et le second carbone porte un chlore et deux fluors.
La masse molaire moléculaire du CFC-113 est de 187,375 g mol−1.
Le temps de vie moyen du CFC-113 est estimé à 90 ans[7]. Cette longue durée de vie signifie que le CFC-113 reste longtemps dans l'atmosphère et peut participer à l'appauvrissement de l'ozone stratosphérique.
Utilisations
On peut citer des utilisations telles que :
- liquide de refroidissement dans les climatiseurs et réfrigérateur : quand le gaz est comprimé, il chauffe, quand il est détendu, il refroidit[8]. Cela le rend idéal pour les systèmes cycliques de compression de vapeur ;
- combustible d'aérosol ;
- agent de nettoyage pour les composants électroniques[9] parce qu'il ne nuit pas aux composants et du fait de sa faible toxicité et inflammabilité[10].
Dans les laboratoires d'analyse, le CFC-113 a été remplacé par d'autres solvants[11].
Le CFC-113 est également une molécule très volatile et apolaire, on peut donc l'utiliser comme agent moussant dans la production de matériaux d'emballage, isolation, mousses de rembourrage ou encore semelles de chaussures.
Effets sur l'environnement
Destruction de l'ozone
Le CFC-113 a un effet fortement négatif sur l'environnement du fait de la scission d'ozone qu'il provoque dans la stratosphère. Il a un temps de vie assez long, d'environ 90 ans, il reste donc dans la stratosphère, où il va être rompu par radiations UV. Ils sont photodissociés par plusieurs radiations solaires de longueurs d'onde différentes dans la gamme de 190–225 nm[9]. Le CFC-113 peut être rompu photochimiquement selon cet exemple :
- CCl2F2 + UV (<220 nm) ⇒ Cl + CClF2.
Cette réaction libère du chlore (Cl) qui est le principal destructeur de l'ozone. Ceci est néfaste pour la planète car 90 % de l'ozone de la Terre[12] se situe dans la stratosphère et peut dès lors être potentiellement dissocié par la présence de chlore, suivant ce cycle :
- Cl + O3 ⇒ ClO + O2.
Cela se produit en seulement une demi-seconde et est suivi de :
- ClO + O ⇒ Cl + O2.
Ce procédé ne dure que quelques minutes[10]. La fin de la réaction montre comment le chlore détruit l'ozone et est ensuite libéré, sous forme de O. Cette espèce est appelée « radical libre », signifiant qu'il peut aller et venir jusqu'à détruire un maximum de O3. Ce processus entier continue pour toute la durée de vie atmosphérique du chlore, d'environ un à deux ans. Durant cette période, il peut détruire 100 000 molécules d'ozone. Puisque l'ozone est un composé essentiel de la biosphère terrestre contre les radiations UV du Soleil, c'est évidemment une dégradation majeure de la nature. La non-filtration des radiations UV par la couche d'ozone peut affecter la peau (cancer de la peau) ou la vue (jusqu'à la perte totale)[9].
Effets sur la santé humaine
Toxicologie professionnelle
Le trichlorotrifluoroéthane fait partie des solvants halogénés les moins dangereux. Cependant, du fait de sa volatilité et de la toxicité des produits libérés par sa décomposition thermique, des mesures de prévention [13] sont recommandées lors de son stockage et de sa manipulation. Aux fortes concentrations, une dépression du système nerveux central, une irritation pulmonaire et une arythmie cardiaque ont été observées, qui peuvent être mortelles. A l'embauche, il conviendra donc de vérifier que le salarié ne présente pas d'affection respiratoire chronique ou cardiaque, notamment si l'exposition accidentelle risque d'être importante.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « 1,1,2-Trichloro-1,2,2-trifluoroethane » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 76-13-1 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 28/05/09 (JavaScript nécessaire)
- (en) Nicholas P. Chopey, Handbook of Chemical Engineering Calculations, McGraw-Hill, , 3e éd., 800 p. (ISBN 978-0-07-136262-7), p. 1.43
- « 1,1,2-Trichloro-1,2,2-trifluoroethane », sur hazmap.nlm.nih.gov (consulté le )
- « Fiche toxicologique », INRS, (consulté le )
- Philip Shabecoff, « New Compound Is Hailed as Boon to Ozone Shield », The New York Times, (lire en ligne, consulté le )
- (en) « Global Change 2: Climate Change », University of Michigan, (consulté le )
- (en) Steven Zumdahl (trad. de l'anglais), Chemical Principles, Lexington, D. C. Heath, , 2e éd., 1137 p. (ISBN 978-0-669-39321-7, LCCN 94076934)
- (en) Chlorofluorocarbons, Columbia Encyclopedia, (lire en ligne)
- (en) « HUMAN DIMENSIONS OF GLOBAL ENVIRONMENTAL CHANGE », University of Columbia (consulté le )
- (en) Use of Ozone Depleting Substances in Laboratories. TemaNord 516/2003
- Molina, Mario J. Role of chlorine in the stratospheric chemistry. Pure and Applied chemistry. 1996.
- Fiche Toxicologique INRS FT65
