Abacarus hystrix
Abacarus hystrix, le Callyntrote porc-épic[3], est une espèce d'acarien de la famille des Eriophyidae. Inféodé aux graminées, notamment à Elymus repens, il produit des galles et décolore les feuilles qui se développent incomplètement et restent enroulées dans le bourgeon. Ce petit acarien est également le vecteur de la maladie virale de la mosaïque du ray-grass, une maladie grave des prairies tempérées qui cause des pertes économiques importantes en agriculture, principalement dans les cultures de Ray-grass d'Europe et d'Amérique du Nord.
| Règne | Animalia |
|---|---|
| Embranchement | Arthropoda |
| Classe | Arachnida |
| Ordre | Trombidiformes |
| Famille | Eriophyidae |
| Genre | Abacarus |
- Callyntrotus hystrix Nalepa, 1896[2]
Description
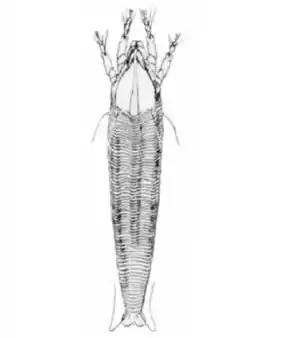
Abacarus hystrix est extrêmement petit, la femelle mesurant 210 μm de long incluant les chélicères et 40 μm de large et le mâle 130 μm de long pour 36 μm de large. Il est reconnaissable à sa forme faiblement fusiforme, à sa couleur blanchâtre ou jaunâtre (plus rarement orange) et à sa griffe plumeuse à 8 rayons. Le bouclier presque triangulaire mesure 44 μm long, 47 μm de large et son bord antérieur est pointu. Son abdomen est parcouru d'environ 70 sternites accompagné de crêtes dorsales longitudinales chitinisées, d'où son épithète spécifique, Hystrix étant le nom générique des Porc-épics à crête. Les tergites, légèrement moins nombreux, sont étroits et ponctués[4],[1].
La galle est caractérisée par une feuille vert blanchâtre à grisâtre incomplètement dépliée et restant enroulée dans le bourgeon[1],[5],[6]
Distribution
Le Callyntrote porc-épic se rencontre dans les prairies permanentes en Europe, en Amérique du Nord, en Afrique du Sud et en Australie[7],[8],[9].
Biologie
Lorsque l'acarien se nourrit des rainures de la surface des feuilles, il préfère les grandes cellules proche de la nervure centrale des feuilles[8] C'est lors de l'alimentation que les acariens peuvent être remarqués par la décoloration de la feuille[9].
Les œufs d'Abacarus hystrix sont placés dans les sillons des nervures des feuilles par la femelle. Ils commencent généralement à éclore au début du printemps (mars dans l'hémisphère nord et septembre dans l'hémisphère sud) et sont élevés dans le haut de la plante. Les acariens se développent très rapidement, soit entre 16 et 20 jours. Une fois qu'ils sont adultes, ils se déplacent vers la partie inférieure de la plante où ils se nourrissent de jeunes tissus des feuilles. Le processus d'alimentation allant du haut vers le bas entraîne une stratification verticale de la feuille orangée. Les acariens sont présents tout au long de la croissance de la plante, mais l'activité diminue à mesure que la température augmente, car contrairement aux autres espèces d'acariens, Abacarus hystrix préfère les températures fraîches. Les acariens hivernent dans partie haute du feuillage[4],[9].
Abacarus hystrix produit jusqu'à vingt générations par an dans les pâturages pérennes d'Australie du Sud[10]. Le nombre d'acarien est plus élevé en automne, coïncidant avec une forte croissance de l'hôte. Les populations diminuent rapidement en hiver, suivies par une augmentation graduelle au printemps et au début de l'été. La migration grâce au vent, qui se produit à la fin du printemps et pendant l'été, est associée à une baisse générale de la qualité des herbes, ce qui entraîne une diminution des populations à la fin de l'été[9].
A. hystrix se retrouve souvent en population mixte avec des espèces inquilines, notamment avec Aculodes mckenziei aux États-Unis, dans le sud-est de l'Australie et en Nouvelle-Zélande, et avec Aculodes dubius au Royaume-Uni et dans le centre-sud de l'Australie[9].
Hôte de virus
Abacarus hystrix est vecteur de deux virus de la mosaïque : le virus de la mosaïque de l'agropyron (VMA) et le virus de la mosaïque du ray-grass (VMRG) et provoque également des dégâts directs sur la feuille. Cependant, l'impact du VMA reste faible. Abacarus hystrix n'est pas un vecteur du virus de la mosaïque des céréales, bien qu'il visite et se nourrit de plantes victimes de ce virus. La raison probable de l'absence de transmission réussie est la dégradation des particules virales pendant la digestion[8],[11].
L'effet du virus de la mosaïque du ray-grass, qui n'est transmis que par cet acarien, laisse des stries chlorotiques sur les feuilles[12],[13]. A. hystrix ne peut le transmettre que pendant 24 heures et tous les stades de développement sont des vecteurs potentiel[11].
L'effet du virus de la mosaïque du ray-grass, suit un schéma similaire à celui de son unique vecteur, les acariens transportés par le vent étant responsables de la plus grande partie de la propagation à distance du VMRG. Les foyers initiaux sont établis par les acariens aériens en été et, bien que la coupe transmette le virus à l'intérieur des parcelles, la plupart des transmissions ultérieures à l'intérieur des parcelles se produisent lorsque la population d'acariens augmente à l'automne et au printemps suivants. Dès que le virus de la mosaïque du ray-grass commence à dégrader sensiblement la santé de l'hôte, le vecteur commence à abandonner la plante au profit de voisins en meilleure santé - la transmettant à nouveau[9],[11].
Il y a également une corrélation entre la faible teneur en azote des parcelles, la présence d'un plus grand nombre d'acariens et la faible incidence de VMRG[9].
Impact parasitaire
La description du Callyntrote porc-épic provient de plants d'Elymus repens, le chiendent, une espèce de graminée vivace très commune, mais plus de 60 espèces de graminées hôtes sont référencées, y compris l'Avoine cultivée, l'Orge commune, le Blé et l'Ivraie[7],[8]. La combinaison espèce végétale et symptôme est insuffisante pour une identification fiable de l'espèce[5].
L'acarien a longtemps été considéré comme un hôte généraliste chez qui la spécialisation de l'hôte ne serait pas susceptible d'évoluer. Cependant, il s'avère qu,Abacarus hystrix est un complexe d'espèces cryptiques et la spécialisation associée à l'hôte est possible. Elle existe par exemple pour les espèces propres au Chiendent, celles propres au Ray-grass et d'autres liées au Brome inerme[14],[15].
Plus précisément, les espèces hôtes concernées en Europe sont Agropyron cristatum, Agrostis capillaris, gigantea ; stolonifera, Alopecurus pratensis, Anisantha sterilis, Anisantha tectorum, Apera spica-venti, Arrhenatherum elatius, Avena sativa, Avenula pubescens, Bromopsis erecta, Bromopsis inermis, Bromopsis ramosa, Bromus hordeaceus, Calamagrostis arundinacea, Calamagrostis epigeios, Ceratochloa carinata, Corynephorus canescens, Dactylis glomerata, Elymus repens, Festuca ovina, Festuca rubra, Festulolium braunii, Festulolium loliaceum, Helictochloa pratensis, Holcus lanatus, Hordeum brevisubulatum, Hordeum murinum, Hordeum vulgare, Leymus arenarius, Lolium x hybridum, Helictochloa multiflorum, Helictochloa perenne, Melica nutans, Melica uniflora, Ochlopoa annua, Phalaroides arundinacea, Phleum pratense, Poa angustifolia, Poa pratensis, Puccinellia distans, Schedonorus arundinaceus, Schedonorus giganteus, Schedonorus pratensis, Sesleria caerulea, Triticale rimpaui et Triticum aestivum[5].
L'alimentation d'A. hystrix cause peu de dommages directs aux plantes hôtes, sauf à des densités très élevées où la croissance peut être retardée et où les dommages cuticulaires peuvent provoquer un flétrissement. La transmission du VMRG, cependant, peut causer des pertes substantielles dans la production de pâturages. La cause principale de la baisse des rendements est une diminution nette de la photosynthèse et une augmentation de la respiration dans l'obscurité, associées à une diminution du tallage. Les effets du VMRG sont plus importants à des niveaux élevés d'azote et sont plus prononcés pendant les périodes de production maximale d'herbe au printemps et à l'automne. En Australie, l'infection de variétés sensibles comme le ray-grass annuel peut diminuer les rendements jusqu'à 27% et, dans les prairies mixtes, retarder la compétitivité. L'augmentation de la croissance des mauvaises herbes compense la réduction de la part de ray-grass et le rendement total en herbe n'est pas été affecté. Les pertes estimées au champ dans l'ouest de l’Écosse, où une infection de 50-60% par le VMRG n'est pas inhabituelle, se situent entre 2 et 10%. Les pertes peuvent être aggravées par des infections mixtes avec d'autres virus comme le Virus sphérique du raygrass ou le Virus nain jaune de l'orge[9].
Gestion de l'infestation
Le diagnostic s'effectue par des contrôles réguliers avant le printemps, lors desquels la recherche se concentre sur les œufs et les acariens juvéniles dans la partie haute des nervures des feuilles[4].
La gestion des pâturages, en particulier l'intensité de la défoliation par la coupe ou le pâturage, a un effet marqué sur la dynamique des populations dA. hystrix. La coupe des parcelles à 4 cm réduit le nombre d'acariens et retarde la propagation du VMRG, mais l'enlèvement de l'herbe coupée n'a aucun effet sur l'abondance des acariens ou l'incidence du VMRG. Le brûlage des parcelles après récolte augmente de manière significative la biomasse végétale et le rendement en graines, et diminue le nombre d'acariens, sur une période de 6 mois, mais ses effets bénéfiques sont contrebalancés par les dommages causés aux collets et aux racines des plantes[9].
Trois espèces de champignons pathogènes du genre Hirsutella, dont H. thompsonii, et Lecanicillium lecanii sont des parasites d'A. hystrix sur les prairies de ray-grass du Royaume-Uni, provoquant une mortalité allant jusqu'à 16%. Mais l'influence de ces pathogènes reste largement indéterminée[9].
Quant aux acaricides, ils empêchent la colonisation par les acariens et diminuent la propagation du VMRG à partir de vieilles prairies. Cependant, leur efficacité est corrélée à des effets secondaires et des réactions en chaîne mal comprises qui peuvent s'avérer catastrophiques sur les moyen et long termes[9].
La résistance de la plante hôte est reconnue comme la voie la plus plausible pour un contrôle à long terme. Il est probable que les progrès récents dans la manipulation génétique et la culture de tissus de Poaceae, ainsi que la pression économique et politique mondiale croissante pour réduire les intrants de pesticides dans la production extensive, puissent accélérer la diffusion de cultivars résistants aux acariens/virus[9].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Abacarus hystrix » (voir la liste des auteurs).
- (de) Nalepa A., Eriophyidae (Phytoptidae), vol. 4, Berlin, Das Tierreich (R. Friedländer und sohn), (lire en ligne)
- GBIF Secretariat. GBIF Backbone Taxonomy. Checklist dataset https://doi.org/10.15468/39omei accessed via GBIF.org, consulté le 10 mai 2022
- Deyrolle, Émile & Groult, Paul, « Les ennemis du blé », Le Naturaliste, 2e série, vol. 22, nos 500-523, , p. 95 (lire en ligne)
- « Cereal Rust Mite in Timothy, Fact Sheets », sur web.archive.org, (consulté le )
- (en) W.N. Ellis, « Abacarus hystrix (Nalepa, 1896) - cereal rust mite », sur Plant Parasites of Europe ; leafminers, galls and fungi,
- Clodomir Houard, Les zoocécidies des plantes d'Europe et du bassin de la Méditerranée. Description des galles, Paris, A. Hermann, 1908-13 (lire en ligne)
- Skoracka, A. 2008. Quackgrass- and ryegrass-adapted populations of the cereal rust mite, Abacarus hystrix (Acari: Eriophyidae), differ in their potential for wheat, Triticum aestivum, colonization. Bulletin of Entomological Research, 99 pp. 33-39.
- Gibson, R. 1974. Studies on the feeding behaviour of the eriophyid mite Abacarus hystrix, a vector of grass viruses. Annals of Applied Biology, 78 (3), pp. 213-217.
- (en) Lindquist, E. E., Bruin, J., & Sabelis, M. W., Eriophyoid mites: their biology, natural enemies and control, Elsevier, , 787 p. (ISBN 9780080531236)
- Frost, W. 1997. Polyphenic wax production in Abacarus hystrix (Acari: Eriophyidae), and impfications for migratory fitness. Physiological Entomology, 22 pp. 37 - 46.
- G. N. Oldfield et G. Proeseler, Eriophyoid mites - Their Biology, Natural Enemies, and Control, vol. 6, M.W. Evert, coll. « World Crop Pests », , 259–275 p. (ISBN 978-0-444-88628-6, ISSN 1572-4379, OCLC 162131094), « Ch. 1.4.9 Eriophyoid Mites as Vectors of Plant Pathogens »
- « Mulligan, T. 1960. The Transmission by Mites, Host-Range and Properties of Ryegrass Mosaic Virus. Annals of Applied Biology, 48 (3), pp. 575 - 579. »
- (en) Anna Skoracka, « Reproductive barriers between populations of the cereal rust mite Abacarus hystrix confirm their host specialization », Evolutionary Ecology, vol. 22, no 5, 2007-06-0 6, p. 607 (ISSN 1573-8477, DOI 10.1007/s10682-007-9185-5, lire en ligne, consulté le )
- (en) Skoracka A & Dabert M, « The cereal rust mite Abacarus hystrix (Acari: Eriophyoidea) is a complex of species: evidence from mitochondrial and nuclear DNA sequences », Bulletin of entomological Research, vol. 100, no 3, , p. 263-272 (lire en ligne)
- (en) Anna Skoracka, Lechosław Kuczyński et Brian G. Rector, « Divergent Host Acceptance Behavior Suggests Host Specialization in Populations of the Polyphagous Mite Abacarus hystrix (Acari: Prostigmata: Eriophyidae) », Environmental Entomology, vol. 36, no 4, , p. 899–909 (ISSN 0046-225X et 1938-2936, DOI 10.1093/ee/36.4.899, lire en ligne)
Bibliographie
Liens externes
- (en) Référence Animal Diversity Web : Abacarus hystrix (consulté le )
- (en) Référence BioLib : Abacarus hystrix (Nalepa, 1896) (consulté le )
- (fr+en) Référence EOL : Abacarus hystrix (Nalepa 1896) (consulté le )
- (en) Référence Fauna Europaea : Abacarus hystrix (Nalepa, 1896) (consulté le )
- (fr+en) Référence GBIF : Abacarus hystrix (Nalepa, 1896) (consulté le )
- (fr) Référence INPN : Abacarus hystrix (Nalepa, 1896) (consulté le )
- (en) Référence IRMNG : Abacarus hystrix (Nalepa, 1896) (consulté le )
- (en) Référence OEPP : Abacarus hystrix (Nalepa) (consulté le )
- (en) W.N. Ellis, « Abacarus hystrix (Nalepa, 1896) - cereal rust mite », sur Plant Parasites of Europe ; leafminers, galls and fungi,
- Portail de l’arachnologie
- Portail de la protection des cultures
- Portail des Poaceae