Acétate d'hexyle
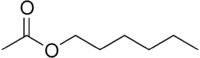
L'acétate d'hexyle ou éthanoate d'héxyle est l'ester de l'acide acétique (acide éthanoïque) avec l'hexanol et de formule semi-développée CH3COO(CH2)5CH3. Il est utilisé principalement comme solvant pour résines, polymères, graisses et huiles. C'est également un additif pour peinture pour améliorer la dispersion de la peinture sur une surface[8]. Cet ester est aussi employé comme arôme notamment dans des compositions fruités et est présent dans l'odeur de nombreux fruits et boissons alcoolisées[9].
| Acétate d'hexyle | |
| |
| Identification | |
|---|---|
| Nom UICPA | éthanoate d'hexyle |
| Synonymes |
acétate de n-hexyle |
| No CAS | |
| No ECHA | 100.005.066 |
| No CE | 205-572-7 |
| PubChem | 8908 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore |
| Propriétés chimiques | |
| Formule | C8H16O2 [Isomères] |
| Masse molaire[1] | 144,211 4 ± 0,008 1 g/mol C 66,63 %, H 11,18 %, O 22,19 %, |
| Propriétés physiques | |
| T° fusion | −80 °C [2] |
| T° ébullition | 171,5 °C [2] |
| Solubilité | 0,4 g·l-1 (eau,20 °C) [2] |
| Masse volumique | 0,867 3 g·cm-3 à 25 °C [3]
|
| T° d'auto-inflammation | 265 °C [2] |
| Point d’éclair | 56 °C [2] |
| Viscosité dynamique | 1,118 mPa·s à 20 °C [3]
|
| Thermochimie | |
| ΔfusH° | 19,83 kJ·mol-1 à −61,05 °C[4] |
| ΔvapH° | 51,9 kJ·mol-1 à 25 °C[5] |
| Précautions | |
| NFPA 704[6] | |
| Transport[2] | |
| Écotoxicologie | |
| LogP | 2,96 [7] |
| Unités du SI et CNTP, sauf indication contraire. | |
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Hexyl acetate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 juillet 2010 (JavaScript nécessaire)
- (en) Hiannie Djojoputro et Suryadi Ismadji, « Density and Viscosity Correlation for Several Common Fragrance and Flavor Esters », Journal of Chemical & Engineering Data, vol. 50, no 2, , p. 727-731 (DOI 10.1021/je050001c)
- (en) Eugene S. Domalski et Elizabeth D. Hearing, « Heat Capacities and Entropies of Organic Compounds in the Condensed Phase. Volume III », J. Phys. Chem. Ref. Data, vol. 25, no 1, , p. 1-525 (DOI 10.1063/1.555985)
- (en) Eugene L. Krasnykh, Sergey P. Verevkin, Bohumir Koutek et Jan Doubsky, « Vapour pressures and enthalpies of vaporization of a series of the linear n-alkyl acetates », J. Chem. Thermodyn., vol. 38, no 6, , p. 717-723 (DOI 10.1016/j.jct.2005.08.003)
- UCB Université du Colorado
- (en) Hideji Tanii, Jian Huang, Takao Ohyashiki et Kazuo Hashimoto, « Physical-chemical-activity relationship of organic solvents: Effects on Na+-K+-ATPase activity and membrane fluidity in mouse synaptosomes », Neurotoxicology and Teratology, vol. 16, no 6, , p. 575-582 (DOI 10.1016/0892-0362(94)90035-3)
- (en) Dieter Stoye, Solvents, Wiley-VCH Verlag GmbH & Co, coll. « Ullmann's Encyclopedia of Industrial Chemistry », (DOI 10.1002/14356007.a24_437, présentation en ligne)
- (en) Karl-Georg Fahlbusch, Franz-Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen, Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg, Flavors and Flagrances, Wiley-VCH Verlag GmbH & Co, coll. « Ullmann's Encyclopedia of Industrial Chemistry », (DOI 10.1002/14356007.a11_141, présentation en ligne)
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.

