Acétate d'isopropyle
L'acétate d'isopropyle est un solvant organique de formule brute C5H10O2 contenant un groupe ester.
| Acétate d'isopropyle | |

| |
| Identification | |
|---|---|
| Synonymes |
paracétate |
| No CAS | |
| No ECHA | 100.003.238 |
| No CE | 203-561-1 |
| PubChem | 7915 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C5H10O2 [Isomères] |
| Masse molaire[1] | 102,131 7 ± 0,005 3 g/mol C 58,8 %, H 9,87 %, O 31,33 %, |
| Propriétés physiques | |
| T° fusion | −72,8 °C[2] |
| T° ébullition | 89 °C[2] |
| Solubilité | 18,9 g l−1 (eau, 20 °C)[2], éthanol, acétone[réf. souhaitée]. |
| Masse volumique | 0,872 g cm−3 à 20 °C[3]. |
| T° d'auto-inflammation | 425 °C[2] |
| Point d’éclair | 2 °C[2] |
| Limites d’explosivité dans l’air | 1,8–8 %vol[2] |
| Viscosité dynamique | 0,57 mPa s à 20 °C[3] |
| Point critique | 258,85 °C, 32,9 bar[4] |
| Thermochimie | |
| ΔfH0gaz | −489,7 kJ·mol-1[4] |
| ΔfH0liquide | −526,9 kJ·mol-1[4] |
| ΔvapH° | 37,2 kJ·mol-1[4] |
| Cp | 196,6 J·K-1·mol-1 (liquide, 25 °C) 158,99 J·K-1·mol-1 (gaz, 103,76 °C)[4] |
| PCI | −2 869,8 kJ mol−1 (liquide)[4] |
| Propriétés optiques | |
| Indice de réfraction | 1,377 3[3] |
| Précautions | |
| SIMDUT[6] | |
 B2, |
|
| NFPA 704[7] | |
| Directive 67/548/EEC[8] | |
 Xi  F |
|
| Transport[2] | |
| Écotoxicologie | |
| DL50 | 6,75 g kg−1 (rat, oral)[9] |
| LogP | 1,02[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
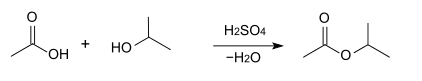
Production et synthèse
Par l'estérification directe du propan-2-ol avec l'acide acétique en présence d'un catalyseur tel que l'acide sulfurique, le sulfate de diéthyle, l'acide chlorosulfonique ou du trifluorure de bore[10].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Isopropyl acetate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 16 juin 2010 (JavaScript nécessaire).
- (en) Dieter Stoye, Solvents, Wiley-VCH Verlag, coll. « Ullmann's Encyclopedia of Industrial Chemistry », (DOI 10.1002/14356007.a24_437, présentation en ligne).
- (en) « Acetic acid, 1-methylethyl ester », sur NIST/WebBook, consulté le 16 juin 2010.
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub., (ISBN 0-88415-858-6).
- « Acétate d'isopropyle » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 16 juin 2010.
- UCB, université du Colorado.
- « acétate d'isopropyle », sur ESIS, consulté le 16 juin 2010.
- (en) « Acétate d'isopropyle », sur ChemIDplus, consulté le 16 juin 2010.
- (en) Junzo Otera et Joji Nishikido, Esterification: Methods, Reactions, and Applications, Weinheim, Wiley-VCH Verlag GmbH & Co., , 2e éd. (ISBN 978-3-527-32289-3), p. 312.
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.

