Acide hexanoïque
L'acide hexanoïque, aussi appelé acide caproïque, est un acide carboxylique, de formule C5H11COOH. C'est un liquide huileux à l'odeur de fromage et de fruit (ananas), voire de bouc (d'où le nom caproïque)[7].
| Acide hexanoïque | |||
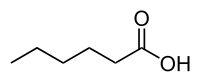
| |||
 | |||
| structure de l'acide caproïque | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | Acide hexanoïque | ||
| Synonymes |
Acide butylacétique |
||
| No CAS | |||
| No ECHA | 100.005.046 | ||
| No CE | 205-550-7 | ||
| FEMA | 2559 | ||
| Apparence | liquide huileux, incolore, d'odeur caractéristique[1] | ||
| Propriétés chimiques | |||
| Formule | C6H12O2 [Isomères] |
||
| Masse molaire[2] | 116,158 3 ± 0,006 2 g/mol C 62,04 %, H 10,41 %, O 27,55 %, |
||
| Diamètre moléculaire | 0,632 nm [3] | ||
| Propriétés physiques | |||
| T° fusion | −3 °C[1] | ||
| T° ébullition | 205 °C[1] | ||
| Solubilité | dans l'eau à 20 °C : 11 g·l-1[1] | ||
| Paramètre de solubilité δ | 24,6 J1/2·cm-3/2 (25 °C)[3] | ||
| Masse volumique | 0,921 2 g·cm-3 à 25 °C[4] | ||
| T° d'auto-inflammation | 380 °C[1] | ||
| Point d’éclair | 102 °C (coupelle ouverte)[1] | ||
| Limites d’explosivité dans l’air | 1,3–9,3 %vol[1] | ||
| Pression de vapeur saturante | à 20 °C : 27 Pa[1] | ||
| Thermochimie | |||
| Cp | |||
| Précautions | |||
| SIMDUT[6] | |||
Produit non classé |
|||
| NFPA 704 | |||
| Directive 67/548/EEC | |||
 C |
|||
| Transport | |||
|
|||
| Écotoxicologie | |||
| LogP | 1,88[1] | ||
| Composés apparentés | |||
| Isomère(s) | acide isocaproïque | ||
| Unités du SI et CNTP, sauf indication contraire. | |||
Les sels sont appelés "hexanoates" ou "caproates".
On le trouve dans les huiles essentielles de lavande, petit-grain (issue du bigaradier) et citronnelle.
Cet acide est considéré comme non nocif pour l'Homme, d'où le qualificatif GRAS (numéro fema 2559). Il entre dans la composition de l'arôme de poire, de fruits mûrs, de noix, de beurre, de chocolat, de fromage et de rhum.
Il a été découvert par le chimiste français Michel-Eugène Chevreul en 1823[7].
Notes et références
- ACIDE HEXANOIQUE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) Wai-Ting Vong et Fuan-Nan Tsai, « Densities, Molar Volumes, Thermal Expansion Coefficients, and Isothermal Compressibilities of Organic Acids from 293.15 K to 323.15 K and at Pressures up to 25 MPa », J. Chem. Eng. Data, vol. 42, no 6, , p. 1116-1120 (DOI 10.1021/je970005k)
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-858-6)
- « Acide hexanoïque » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- Pierre de Menten, Dictionnaire de chimie : Une approche étymologique et historique, De Boeck, , 395 p. (ISBN 978-2-8041-8175-8, lire en ligne), p.23
Voir aussi
Liens externes
- Portail de la chimie
- Portail des odeurs, des senteurs et du parfum
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.
