Acide glutarique
L'acide glutarique est un diacide carboxylique aliphatique, dénommé également acide pentanedioïque et de formule semi-développée HOOC-CH2-CH2-CH2-COOH.
| Acide glutarique | |
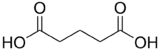
| |
| formule développée de l'acide glutarique | |
| Identification | |
|---|---|
| Nom UICPA | Acide pentanedioïque |
| No CAS | |
| No ECHA | 100.003.471 |
| No CE | 203-817-2 |
| SMILES | |
| InChI | |
| Apparence | cristaux prismes incolores, inodores |
| Propriétés chimiques | |
| Formule | C5H8O4 [Isomères] |
| Masse molaire[1] | 132,114 6 ± 0,005 8 g/mol C 45,46 %, H 6,1 %, O 48,44 %, |
| pKa | pKa1 = 4,35 pKa2 = 5,42 |
| Propriétés physiques | |
| T° fusion | 98 °C[2] |
| T° ébullition | 302 à 304 °C (décomposition)[2] |
| Solubilité | dans l'eau à 20 °C : 639 g·l-1[2] |
| Masse volumique | 1,4 g·cm-3[2] |
| Pression de vapeur saturante | 2 Pa (20 °C) |
| Thermochimie | |
| Cp | |
| Précautions | |
| SIMDUT[4] | |
 E, |
|
| Inhalation | irritant |
| Peau | irritant, corrosif |
| Yeux | irritant, corrosif |
| Ingestion | irritant |
| Écotoxicologie | |
| DL50 | 6 g·kg-1 (souris, voie orale) |
| Unités du SI et CNTP, sauf indication contraire. | |
Cet acide est commun dans de nombreux produits végétaux, en particulier dans le sucre de betterave non purifié.
Les glutarates sont les sels de l'acide glutarique. Plus généralement, on appelle aussi glutarates les divers composés dérivés de l'acide glutarique par substitution d'un ou des deux hydrogènes des fonctions hydroxyles.
Propriétés
À température ambiante, l'acide glutarique est un solide cristallin, sous forme de petits prismes incolores. Il fond à 98 °C. Ce composé disparaît à 303 °C sous forme d'eau vapeur, de monoxyde de carbone et dioxyde de carbone. À une pression de 20 mmHg, le point d'ébullition avoisine 200 °C.
Il présente une solubilité appréciable dans l'eau, comparée à celles des diacides carboxyliques de chaine aliphatique de taille proche, l'acide succinique ou l'acide adipique.
Par chauffage au reflux dans un solvant organique approprié, comme le 1,1,2, trichloroéthane, l'acide glutarique se transforme en un anhydride cyclique, anhydride pentanedioïque ou anhydride glutarique.
Usage
C'est un intermédiaire de fabrication dans les fabriques de produits organiques et pour la chimie macromoléculaire. L'acide glutarique est un des monomères pour l'obtention de polyesters, de polyols ou polyamides aux caractéristiques mécaniques plus rigides[5]. Par hydrogénation catalytique, il donne un diol aliphatique, le pentane-1,5-diol, plastifiant ou même monomère pour divers polyesters.
Sécurité et toxicité
Son emploi nécessite la protection des yeux et de la peau, ainsi qu'une bonne ventilation. Il faut le conserver, en récipient hermétique, au sec et au frais, à l'abri d'acides et de bases, des matières oxydantes et des agents réducteurs.
L'acide glutarique est un produit chimique irritant et corrosif pour la peau et les muqueuses.
Littérature
- Beilstein 2, 631 I 272 II 564 III 1685 IV 1934
- Ullmann (5.)8, 533
- Merck Index 11, 4367
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- ACIDE GLUTARIQUE, Fiches internationales de sécurité chimique
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 2, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-858-6)
- « Acide glutarique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- L'emploi de l'acide adipique ou de diacides ou diols terminaux à chaînes aliphatiques plus longues accroissent singulièrement l'élasticité des polymères synthétisés.