Acide sulfoxylique
L’acide sulfoxylique, ou acide hyposulfureux, est un composé chimique hypothétique de formule H2SO2. C'est un oxoacide de soufre dont l'atome de soufre est à l'état d'oxydation +2.
| Acide sulfoxylique | |
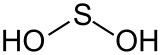
| |
| Structure de l'acide sulfoxylique | |
| Identification | |
|---|---|
| Nom UICPA | sulfanediol |
| Synonymes |
acide hyposulfureux |
| No CAS | |
| PubChem | 5460696 |
| ChEBI | 33536 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | H2SO2 |
| Masse molaire[1] | 66,08 ± 0,006 g/mol H 3,05 %, O 48,42 %, S 48,53 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Cet acide, instable aux conditions du laboratoire, se dismuterait immédiatement à température ambiante en dioxyde de soufre SO2 et en soufre élémentaire S8, à l'instar du monoxyde de soufre SO, son anhydride formel. Ses sels, également hypothétiques, sont appelés sulfoxylates ou hyposulfites et seraient des réducteurs énergiques également instables. L'acide sulfinique HSOOH est formellement un tautomère de l'acide sulfoxylique.
L'acide sulfoxylique se formerait comme intermédiaire transitoire et non isolable lors de l'hydrolyse des dihalogénures de soufre, tels que le dichlorure de soufre SCl2. Il ne peut être obtenu par hydratation du monoxyde de soufre, lui-même trop instable aux conditions du laboratoire.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Portail de la chimie