Acide oxaloacétique
L'acide oxaloacétique, dont la base conjuguée est l'oxaloacétate, est un acide dicarboxylique de formule HOOC–CO–CH2–COOH. Il s'agit d'une substance cristallisable qui apparaît notamment comme intermédiaire du cycle de Krebs, de la néoglucogenèse, du cycle de l'urée, du cycle du glyoxylate, de la biosynthèse des acides gras, et de celle de certains acides aminés.
| Acide oxaloacétique | |||

| |||
| Structure de l'acide oxaloacétique | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | acide 2-oxobutanedioïque | ||
| Synonymes |
acide 2-oxosuccinique |
||
| No CAS | |||
| No ECHA | 100.005.755 | ||
| No CE | 206-329-8 | ||
| PubChem | 970 | ||
| ChEBI | 30744 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C4H4O5 [Isomères] |
||
| Masse molaire[1] | 132,071 6 ± 0,005 g/mol C 36,38 %, H 3,05 %, O 60,57 %, |
||
| Propriétés physiques | |||
| T° fusion | 161 °C déc | ||
| Précautions | |||
| SGH[2] | |||
 Danger |
|||
| SIMDUT[3] | |||
Produit non contrôlé |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Déprotonation
L'acide oxaloacétique subit deux déprotonations successives pour conduire au dianion :
À pH élevé, le proton énolisable devient également labile :
- −OOC–CO–CH2–COO− −OOC–CO−=CH–COO−, pKa = 13,03
Les formes énoliques de l'oxaloacétate sont particulièrement stables, au point que les isomères cis et trans ont deux températures de fusion distinctes : 152 °C pour l'isomère cis et 184 °C pour l'isomère trans.
Biosynthèse
L'oxaloacétate est produit naturellement de différentes façons. La principale est l’oxydation du L-malate par la malate déshydrogénase à la 10e et dernière étape du cycle de Krebs :
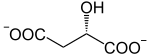
+ NAD+ NADH + H+ + 
L-Malate Oxaloacétate Malate déshydrogénase – EC
Le L-malate est également lentement oxydé en énol-oxaloacétate −OOC–COH=CH–COO− par la succinate déshydrogénase à travers une réaction de promiscuité, l'énol-oxaloacétate étant ensuite converti en oxaloacétate par l'oxaloacétate tautomérase[4].
L'oxaloacétate se forme également par condensation du pyruvate CH3–CO–COO− avec le bicarbonate HCO3− et hydrolyse concomitante d'une molécule d'ATP. Cette réaction a lieu dans le mésophylle des plantes via le phosphoénolpyruvate sous l'action de la pyruvate carboxylase :
Il se forme également par transamination de l'aspartate :

+ 

+ 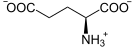
Aspartate α-Cétoglutarate Oxaloacétate Glutamate Aspartate aminotransférase (AST) – EC
Fonctions biochimiques
L'oxaloacétate est un intermédiaire du cycle de Krebs, dans lequel il réagit avec l'acétyl-CoA pour former du citrate sous l'action de la citrate synthase. Il intervient également dans la néoglucogenèse, le cycle de l'urée, le cycle du glyoxylate, la biosynthèse d'acides aminés et la biosynthèse des acides gras.
L'oxaloacétate est également un inhibiteur puissant de la succinate déshydrogénase (complexe II de la chaîne respiratoire).
Cycle de Krebs
L'oxaloacétate est le métabolite qui ferme le cycle de Krebs : c'est en effet un substrat de la première réaction du cycle, pour former le citrate par réaction avec l'acétyl-CoA sous l'action de la citrate synthase[5], et c'est également un produit de la dernière réaction du cycle, par oxydation du L-malate sous l'action de la malate déshydrogénase.

+ acétyl-CoA + H2O → CoA + 
Oxaloacétate Citrate Citrate synthase – EC
Néoglucogenèse
La néoglucogenèse est une voie métabolique comprenant onze réactions catalysées par des enzymes et permettant la biosynthèse du glucose à partir de précurseurs non glucidiques. Elle commence dans la matrice mitochondriale, où se trouve le pyruvate. Ce dernier est converti en oxaloacétate par la pyruvate carboxylase avec hydrolyse concomitante d'une molécule d'ATP, puis l'oxaloacétate est réduit en L-malate par la malate déshydrogénase mitochondriale afin de pouvoir franchir la membrane mitochondriale interne et gagner le cytosol. Là, le L-malate est à nouveau oxydé en oxaloacétate par l'isoforme cytosolique de la malate déshydrogénase. C'est à partir de l'oxaloacétate cytosolique que la suite de la néoglucogenèse conduit au glucose.
Cycle de l'urée
Le cycle de l'urée produit une molécule d'urée à partir d'un anion bicarbonate HCO3− et deux cations ammonium NH4+. Cette voie métabolique se déroule généralement dans les hépatocytes, à partir de NADH dont l'un des modes de production fait intervenir l'oxydation du L-malate en oxaloacétate par la malate déshydrogénase. Ce L-malate du cytosol provient du fumarate sous l'action de la fumarase, tandis que l'oxaloacétate est converti en aspartate par une transaminase, ce qui entretient le flux d'azote dans la cellule.
Cycle du glyoxylate
Le cycle du glyoxylate est une variante du cycle de Krebs faisant intervenir l'isocitrate lyase et la malate synthase et contribuant à l'anabolisme des plantes et des bactéries. Certaines étapes de ce cycle diffèrent légèrement de celles du cycle de Krebs, mais l'oxaloacétate joue le rôle de produit final et de premier réactif dans les deux cycles, à la différence qu'il est un produit net du cycle du glyoxylate car ce dernier incorpore deux molécules d'acétyl-CoA, et non une seule comme le cycle de Krebs.
Biosynthèse des acides gras
Dans ce processus, l'acétyl-CoA est tout d'abord transféré depuis la matrice mitochondriale vers le cytosol, où se trouve l'acide gras synthase, sous forme de citrate après réaction avec l'oxaloacétate sous l'action de la citrate synthase. Le citrate franchit la membrane mitochondriale interne à l'aide de la protéine mitochondriale de transport des tricarboxylates (en). Une fois dans le cytosol, le citrate est à nouveau clivé en oxaloacétate et acétyl-CoA par l'ATP citrate lyase.
Une partie du pouvoir réducteur nécessaire à la biosynthèse des acides gras, utilisé sous forme de NADPH, est généré à partir du NADH cytosolique lors du retour de l'oxaloacétate dans la matrice mitochondriale. L'oxaloacétate est tout d'abord réduit en L-malate par la malate déshydrogénase à partir d'une molécule de NADH, puis le L-malate est décarboxylé en pyruvate par l'enzyme malique à NADP, réaction au cours de laquelle une molécule de NADP+ est réduite en NADPH ; le pyruvate peut ensuite gagner la matrice mitochondriale à travers la membrane interne de la mitochondrie.
Biosynthèse d'acides aminés
Six acides aminés essentiels et trois acides aminés non essentiels sont issus de l'oxaloacétate et du pyruvate. Ainsi, l'aspartate et l'alanine sont respectivement formés à partir d'oxaloacétate et de pyruvate par transamination à partir de glutamate. L'aspartate peut ensuite être converti en asparagine, méthionine, lysine et thréonine, ce qui le rend indispensable pour la production de ces acides aminés protéinogènes.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Oxaloacetic acid ≥ 97% (HPLC), consultée le 16 juillet 2016.
- « Acide oxalacétique » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- (en) M. V. Panchenko et A. D. Vinogradov, « Direct demonstration of enol-oxaloacetate as an immediate product of malate oxidation by the mammalian succinate dehydrogenase », FEBS Letters, vol. 286, nos 1-2, , p. 76-78 (PMID 1864383, DOI 10.1016/0014-5793(91)80944-X, lire en ligne)
- (en) G. Wiegand et S. J. Remington, « Citrate Synthase: Structure, Control, and Mechanism », Annual Review of Biophysics and Biophysical Chemistry, vol. 15, , p. 97-117 (PMID 3013232, DOI 10.1146/annurev.bb.15.060186.000525, lire en ligne)
- Portail de la chimie
- Portail de la biochimie