Acide téflique
L'acide téflique est un composé chimique de formule HOTeF5. C'est un acide fort apparenté à l'acide tellurique Te(OH)6. Sa molécule présente une géométrie octaédrique légèrement déformée.
| Acide téflique | |
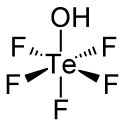
| |
| Structure de l'acide téflique | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.161.534 |
| No CE | 633-471-1 |
| PubChem | 15243876 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | HF5OTe |
| Masse molaire[1] | 239,6 ± 0,03 g/mol H 0,42 %, F 39,65 %, O 6,68 %, Te 53,26 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Préparation
L'acide téflique a été découvert par inadvertance en tentant de synthétiser du fluorure de telluryle TeO2F2 à partir de tellurate de baryum BaTeO4 et d'acide fluorosulfurique HSO3F, réaction qui donna un mélange de composés telluriques volatils, parmi lesquels environ un quart d'acide téflique[2],[3] :
C'est le premier produit de l'hydrolyse de l'hexafluorure de tellure TeF6 :
Téflates
La base conjuguée de l'acide téflique est l'anion téflate F5TeO−, à ne pas confondre avec l'anion triflate CF3SO3−. On connaît de nombreux téflates, comme le composé B(OTeF5)3 et l'anhydride d'acide O(TeF5)2. La pyrolyse du composé de bore donne le dimère (TeF4O)2[3] :
- 2 B(OTeF5)3 → 2 B(OTeF5)2F + (OTeF4)2.
L'anion téflate est connu pour résister à l'oxydation. Cette propriété permet la préparation de plusieurs espèces très inhabituelles telles que l'hexatéflate M(OTeF5)6−, où M = As, Sb ou Bi[4]. Le xénon forme le cation Xe(OTeF5)+.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) A. Engelbrecht et F. Sladky, « Pentafluoro‐orthotellursäure, HOTeF5 », Angewandte Chemie, vol. 76, no 9, , p. 379-380 (DOI 10.1002/ange.19640760912, lire en ligne)
- (en) A. F. Holleman et E. Wiberg, Inorganic Chemistry, Academic Press, San Diego, 2001. (ISBN 0-12-352651-5)
- (en) Helene P. A. Mercier, Jeremy C. P. Sanders et Gary J. Schrobilgen, « Hexakis(pentafluorooxotellurato)pnictate(V) Anions, M(OTeF5)6− (M = As, Sb, Bi): A Series of Very Weakly Coordinating Anions », Journal of the American Chemical Society, vol. 116, no 7, , p. 2921-2937 (DOI 10.1021/ja00086a025, lire en ligne)
- Portail de la chimie