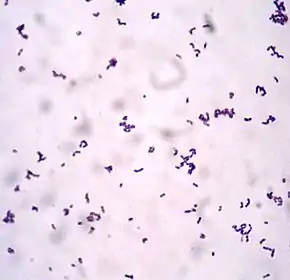
Actinobacteria
Les Actinobacteria, en français Actinobactéries, sont une classe de bactéries filamenteuses, Gram-positives. La majorité de ces espèces plutôt que vivre en liberté ont évolué pour devenir commensales et/ou symbiotes de plantes, champignons, insectes, éponges et d'autres organismes... ou elles sont saprophytes et principalement telluriques ; quelques-unes (ex Mycobacterium) peuvent être pathogènes chez des individus à résistance affaiblie. Certaines vivent à l'intérieur de plantes pour lesquelles elles fixent l'azote de l'air et produisent des antibiotiques naturels[1].
| Règne | Bacteria |
|---|---|
| Embranchement | Actinomycetota |
Ordres de rang inférieur
- sous-classe des Acidimicrobidae:
- ordre Acidimicrobiales
- sous-classe des Actinobacteridae:
- ordre Actinomycetales
- ordre Bifidobacteriales
- ordre Nitriliruptorales
- sous-classe des Coriobacteridae:
- ordre Coriobacteriales
- sous-classe des Rubrobacteridae:
- ordre Rubrobacterales
- ordre Solirubrobacterales
- ordre Thermoleophilales
Elles étaient auparavant appelées actinomycètes, le suffixe mycète renvoyant aux caractéristiques qu'elles ont en commun avec les champignons, mais pour éviter une confusion avec les champignons, on les appelle désormais actinobactéries[2].
Ces bactéries sont réputées anaérobies tandis que les nocardia (à l'instar des streptomycètes qui leur ressemblent) sont aérobies. Quelques cas d'actinomycètes aquatiques (eau douce) semblant aérobies ont été signalés en 1975 au Canada par deux microbiologistes[3].
Avec les cyanobactéries, elles secrètent, lorsqu'elles produisent des spores, la géosmine qui donne au sol l'odeur de terre fraîchement retournée ou mouillée après une période sèche.
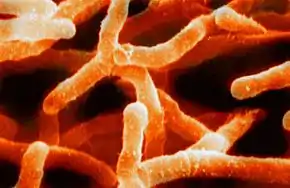
Habitats
Ces bactéries occupent deux types très différents d'habitats :
- Le sol : les actinobactéries libres se trouvent essentiellement dans le sol. Elles comptent parmi les principaux acteurs de la vie du sol et du cycle du carbone en contribuant à la décomposition des matières organiques et en particulier de la cellulose et de la chitine lors du processus de formation de l'humus. Ces bactéries peuvent se regrouper sous forme de filaments qui produisent des cystes (fructifications, ici des endospores) pour résister à un milieu défavorable (par exemple, en présence de myxomycètes).
- D'autres organismes : c'est le cas des actinobactéries symbiotes de plante, de champignons et d'animaux. Ainsi les actinobactéries endophytes (vivant à l'intérieur de plantes) contribuent à la défense de ces plantes et à leur bonne croissance[4].
C'est aussi le cas de quelque pathogènes (ex : Mycobacterium).
La plupart des actinobactéries sont aérobies, mais quelques-unes, comme Actinomyces israelii supportent l'anaérobiose.
Classification
Le groupe des actinomycètes et Nocardia a souvent été présenté comme à cheval entre bactéries et champignons. Il fut décrit par certains parmi les mycoses, par d'autres parmi les infections bactériennes.
Il ne se rapproche en fait des champignons que par l'existence de filaments ramifiés évoquant un mycélium. La ressemblance n'est que morphologique, la phylogénie moléculaire a montré sans appel l'appartenance du groupe aux bactéries ; cette phylogénie est soutenue morphologiquement par la finesse de ces filaments (maximum 1 micron, les filaments mycéliens allant de 2 à 5 microns) et par le fait que, en culture surtout, ces filaments se fragmentent au point de ressembler beaucoup à des bacilles (aspect similaire à celui des Corynebacterium). Par ailleurs, la composition de leur paroi et corrélativement leur sensibilité aux antibiotiques les rapprochent des bactéries.
Beaucoup d'actinobactéries ont des formes filamenteuses évoquant les mycéliums des champignons, où elles étaient initialement classées sous l'ancienne appellation Actinomycètes.
À l'inverse des Firmicutes, autres grands groupes des bactéries gram positive, ils ont un fort pourcentage CG et quelques espèces produisent des exospores.
Principaux genres
Utilisations
Cette famille de bactérie est diversifiée et produit de nombreuses molécules intéressantes pour l'agriculture, les biotechnologies et la médecine, dont la majorité des antibiotiques aujourd'hui utilisés en clinique. Certaines Actinobactéries peuvent cependant être pathogènes, ce qui devrait les faire utiliser prudemment si elles devait l'être vivantes et chez l'homme ou l'animal ; mais ce genre présente aussi une capacité inégalée à produire de nombreux composés organiques complexes présentant souvent un intérêt pharmaceutique.
En particulier,
- Selman Waksman a découvert en 1940 que les bactéries du sol qu'il étudiait produisaient de l'actinomycine. Ceci lui a valu un prix Nobel. Depuis, des centaines d'antibiotiques naturels ont été découverts chez ces microorganismes, en particulier au sein du genre Streptomyces. L'une d'entre elles ne résiste cependant pas à une autre bactérie qui peut la parasiter (voir plus bas).
- Ces bactéries produisent de nombreux antibiotiques et enzymes (dont certains dégradent les polymères naturels complexes tels que la lignocellulose[1].
- D'après des tests faits en laboratoire, il semble possible d'utiliser des actinomycètes en bioréacteur, en conditions aérobies, pour (lentement) dépolluer de l'air contaminé par le trichloroéthylène (TCE) en les alimentant en phénol (le phénol fournit ici une pression sélective favorisant l'enrichissement spontané en actinomycètes). La culture d'actinomycètes était capable de dégradation du cis-DCE (1,2-Dichloroéthène)[5].
- Biocontrôle : Certaines actinobactéries sont des microbes bénéfiques atténuant divers stress biotiques et abiotiques, et améliorant la croissance des plantes ; (associées aux champignons mycorhyziens) ; elles sont une alternative à l'utilisation de pesticides et d'engrais chimiques[6]. Une difficulté est qu'on connait encore mal les facteurs qui contrôlent l'expression des nombreux gènes biosynthétiques de ces bactéries (apparus lors de leur co-évolution avec leurs hôtes et qui codent une grande diversité de métabolites biochimiques). Ainsi « de nombreux groupes de gènes biosynthétiques pour les antibiotiques sont mal exprimés en condition de laboratoire, mais ils sont probablement exprimés en réponse à des demandes spécifiques à l'hôte »[1].
Parasitose par une microbactérie, et antibiorésistance
À l'occasion d'une analyse métagénomique d'échantillons de salive humaine a été récemment découverte (publication 2016 [7]) une minuscule bactérie parasite de la bactérie Actinomyces odontolyticus. L’ARN de cette bactérie avait déjà été signalé, mais nul ne savait de quel organisme il pouvait provenir[7]. Ce micro-parasite bactérien est dotée d’un patrimoine génétique très petit (700 gènes environ, à comparer aux 2200 gènes d’A. odontolyticus). Il semble fortement dépendant de son hôte (couple A. odontolyticus+ être humain en l’occurrence) [7]. Sa présence est en fait observées depuis plusieurs années, et était déjà associé à certaines formes de gingivites, de fibrose kystique et à des mécanismes de résistance aux antimicrobiens, mais sans que la bactérie ait été identifiée comme organisme parasite et sans que sa biologie ne soit comprise[7]. Comme dans le cas de la seule autre bactérie parasite d’archées connue (Bdellovibrio, découverte un peu plus tôt et classée parmi les « Delta Proteobacteria », une cellule libre très motile et rapide, qui traque des archées pour les parasiter. Elle est en outre dotée d’un patrimoine génétique au contraire plus important que la moyenne pour des bactéries de cette taille[8]. La « nouvelle bactérie salivaire », bien plus petite que la plupart des autres bactéries, peut aussi vivre à la surface de ses bactéries-hôtes ; elle a un patrimoine génétique anormalement restreint qui la rend aussi très dépendante de son hôte. Elle est utile à son hôte mais finalement pathogène pour lui, et indirectement aussi pour l’homme. De telles caractéristiques n’avaient jamais été trouvées chez une bactérie.
Il semble que dans un premier temps, les hôtes (Actinomyces) tolèrent ces micro-parasites qui s’attachent eux-mêmes à sa membrane externe de leur hôte en prélevant des nutriments via la membrane, puis dans un second temps le parasite attaque et tue l’hôte en perçant cette membrane[7]. C’est pourquoi cette espèce n’avait pas été découverte (car elle ne peut être cultivée en boite de Petri indépendamment de son hôte Actinomyces ; ce qui laisse penser que de nombreuses autres bactéries parasites pourraient exister sans avoir été découvertes, pour la même raison, car de nombreux indices (génétiques notamment) plaident pour des interactions durables entre microbes, parasitaires notamment)[7].
Pathogénicité : ce micro-parasite pourrait être directement ou indirectement lié à certaines maladies car des taux plus élevés de son ADN ont été retrouvés chez des patients victimes de maladies des gencives ou de fibrose kystique. Les Actinomyces sont connues pour être potentiellement pathogènes pour les gencives, mais sont normalement contrôlées par les globules blancs (macrophagie), or il semble que les bactéries infectées par le parasite puissent échapper aux macrophages (par un mécanisme encore à éclaircir), ce qui leur permettraient d’impunément de se développer dans les gencives[7].
Antibiorésistance : Curieusement, les deux seules bactéries parasites (d'autres bactéries) connues ont en commun la capacité de rendre leurs hôtes résistants à la streptomycine, point qui pourrait éclairer les phénomènes croissants d’antibiorésistance [7]. Un traitement antibiotique par la streptomycine favorise donc indirectement la bactérie hôte, connue pour être pathogène pour l’Homme.
Notes et références
- (en) Van der Meij A, Worsley S.F, Hutchings M.I & van Wezel G.P (2017) Chemical ecology of antibiotic production by actinomycetes. FEMS microbiology reviews, 41(3), 392-416.
- Jean-Michel Gobat, Michel Aragno, Willy Matthey, Le sol vivant: bases de pédologie, biologie des sols, PPUR Presses polytechniques, , p. 41
- Identification d'actinomycètes aérobies isolés d'eau douce E. Hour Chea, H. Leclerc (1975) Revue canadienne de microbiologie, 21(12): 1895-1900, 10.1139/m75-277
- (en) Conn VM, Walker AR, Franco CMM (2008) Endophytic actinobacteria induce defense pathways in Arabidopsis thaliana. Mol Plant Microbe Interact 21:208–218
- (en) Seung-Bong Lee, Stuart E. Strand & H. David Stensel (2000) Sustained Degradation of Trichloroethylene in a Suspended Growth Gas Treatment Reactor by an Actinomycetes Enrichment ; Environmental Science & Technology, 34, 15, 3261-3268 ; 29 juin|DOI: 10.1021/es9907515 (résumé)
- (en) Palaniyandi S.A, Yang S.H., Zhang, L., & Suh, J. W. (2013). Effects of actinobacteria on plant disease suppression and growth promotion. Applied microbiology and biotechnology, 97(22), 9621-9636 (résumé).
- (en) Andy Coghlan (2016) New life form discovered in saliva is linked to human disease Article publié par New Scientist ; dans “Daily news” le 23 juin 2016
- (en) J. J. Tudor et M. P. McCann, Predatory Prokaryotes, vol. 4, coll. « Microbiology Monographs », , 153 p. (ISBN 978-3-540-38577-6, DOI 10.1007/7171_056), « Genomic Analysis and Molecular Biology of Predatory Prokaryotes »
Voir aussi
Articles connexes
Bibliographie
- (en) Stackebrandt E, F.A. Rainey, N.L. Ward-Rainey, Proposal for a new hierarchic classification system, Actinobacteria classis nov. Int. J. Syst. Bacteriol. (1997) 47:479-491. Résumé
- (en) Van der Meij A, Worsley S.F, Hutchings M.I & van Wezel G.P (2017) Chemical ecology of antibiotic production by actinomycetes. FEMS microbiology reviews, 41(3), 392-416
Liens externes
- (en) Référence Catalogue of Life : Actinobacteria Cavalier-Smith, 2002 (consulté le )
- (fr+en) Référence EOL : Actinobacteria (consulté le )
- (fr) Référence INPN : Actinobacteria Goodfellow, 2012 (consulté le )
- (fr+en) Référence ITIS : Actinobacteria Cavalier-Smith, 2002 (consulté le )
- (en) Référence LPSN : Actinobacteria Stackebrandt et al. 1997 (consulté le )
- (en) Référence NCBI : Actinobacteria (taxons inclus) (consulté le )
- (en) Référence OEPP : Actinobacteria (consulté le )
- (en) Référence Paleobiology Database : Actinobacteria (consulté le )
- (en) Référence Tree of Life Web Project : Actinobacteria (consulté le )
- (en) Référence World Register of Marine Species : taxon Actinobacteria (+ liste espèces) (consulté le )
- Portail de la microbiologie