Réaction de Friedel-Crafts
Les réactions de Friedel-Crafts sont des réactions chimiques de type substitution électrophile aromatique au cours desquelles un cycle benzénique est alkylé (substitution d'un atome d'hydrogène par un groupe alkyle) ou acylé (substitution d'un atome d'hydrogène par un groupe acyle).
Celles-ci ont été développées en 1877 par le chimiste français Charles Friedel et son partenaire américain James Crafts.
Alkylation de Friedel-Crafts
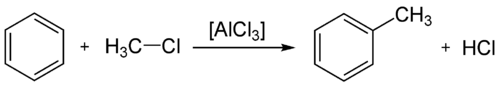
La réaction chimique catalysée par un acide de Lewis, d'un halogénure d'alkyle R-X, et d'un composé aromatique est appelée alkylation de Friedel-Crafts.
Cette réaction présente un certain nombre d'inconvénients :
- le produit est plus nucléophile que le réactif. Il s'ensuit qu'il est très difficile de limiter cette réaction à la substitution d'un seul atome d'hydrogène (H). Pour obtenir une bonne sélectivité, il faut conduire cette réaction pendant de longues heures à basse température, ou bien passer d'abord par l'acylation suivie de la réduction du produit en alkyle ;
- si l'halogénure de départ comporte au moins trois carbones, il peut ne pas se retrouver tel que sur le cycle aromatique. On obtiendra un mélange d'isomères ;
- la réaction avec un halogénure d'aryle Ar-X (ex. : chlorobenzène) ne se prête pas à cette réaction et ne permet pas d'utiliser cette méthode pour coupler deux cycles aromatiques ;
- les solvants et le catalyseur doivent être séparés du mélange réactionnel, pour être détruits ou recyclés.
Les acides de Lewis les plus utilisés sont : AlX3 (X = Br, Cl, I), SbF5, ZnCl2.
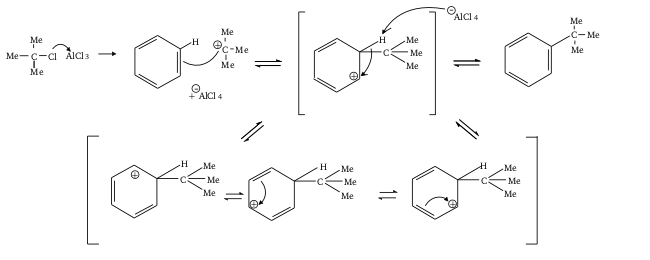
Mécanisme simplifié
Le véritable mécanisme ne passe cependant pas par un carbocation mais par une forme où le chlorure d'aluminium se fixe au pied de la liaison C-Cl et n'en part avec le chlore qu'une fois la liaison avec l'aromatique faite.
Utilisations
Cette réaction est utilisée tant au laboratoire que dans l'industrie, par exemple pour la synthèse du toluène.
Acylation de Friedel-Crafts
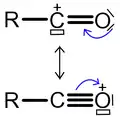
La réaction catalysée par un acide de Lewis, d'un halogénure d'acyle RCOX (bien souvent un chlorure d'acyle) ou d'un anhydride d'acide, et d'un composé aromatique est appelée acylation de Friedel-Crafts.

Les conditions de la réaction sont similaires à celles de l'alkylation présentée ci-dessus. Contrairement au cas de l'alkylation, il ne peut pas y avoir d'acylations multiples. En effet, le groupe carbonyle, attracteur d'électrons, désactive le noyau aromatique, si bien que le produit de la réaction est moins réactif que le produit initial. De plus, il ne peut pas y avoir de réarrangement du carbocation (ion acylium) dans le cas de l'acylation. En revanche, le catalyseur forme un complexe avec le produit final et il en faut une quantité légèrement supérieure au nombre de moles de groupes carbonyle présents dans l'agent acylant.
Ce type de réaction permet de synthétiser une cétone ou un aldéhyde à partir d'un composé aromatique.
Dans la nature
Des réactions de Friedel-Crafts pourraient avoir lieu dans l'océan interne d'Encelade[1].
Références
- (en) N Khawaja, F Postberg, J Hillier, F Klenner, S Kempf, L Nölle, R Reviol, Z Zou et R Srama, « Low-mass nitrogen-, oxygen-bearing, and aromatic compounds in Enceladean ice grains », Monthly Notices of the Royal Astronomical Society, vol. 489, no 9, (lire en ligne).