Annexine II
L'annexine II (autres noms : Annexin II, Annexin A2, Annexin 2, Anx2, Lipocortin II, Calpactin I heavy chain, Chromobindin-8, p36, Placental anticoagulant protein IV) est une protéine de 38 kDa qui fait partie de la famille des annexines. Les annexines sont des protéines qui possèdent une double localisation cellulaire cytosolique et membranaire. Elles font le lien entre la signalisation calcique et la dynamique membranaire, deux fonctions impliquant un même mécanisme de base ; leur liaison réversible et dépendante du Ca2+. De plus leur interaction avec les lipides perturbe la membrane avec des conséquences sur la signalisation cellulaire.
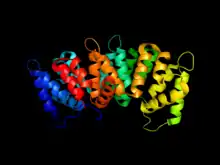
L'Anx2 est structurée en deux domaines : le cœur qui contient les sites de liaison au Ca2+ responsables de la liaison aux membranes, et le domaine N-terminal qui possède le site de liaison à la protéine S100A10 avec laquelle elle forme un tétramère. Le domaine N-terminal régule les propriétés du cœur par dimérisation, liaison à la S100A10 et phosphorylation. En présence du Ca2+, l'Anx2 se lie aux membranes plasmiques via des phospholipides anioniques tels que la phosphatidylsérine (PS) et le phosphatidylinositol (PI) et provoque aussi l’agrégation de ces membranes.
L'Anx2 est impliquée dans les phénomènes d'exocytose et d’endocytose, de coagulation, d’interactions membrane-cytosquelette (actine) et de formation des jonctions intercellulaires. Dans tous ces phénomènes physiologiques, elle interagit avec plusieurs partenaires le principal d’entre eux, comme soulignée plus haut, est la S100A10 appelé aussi P11. S100A10 est une protéine de 11 kDa qui appartient à la famille des protéines S100. Elle interagit avec l’Anx2 avec une très haute affinité et indépendamment du calcium. Elle forme un homodimère (P11)2 qui peut fixer deux molécules d’Anx2 pour former un hétérotétramère (Anx2)2-(P11)2.
L’Anx2 sous forme monomérique ou hétérotétramèrique en complexe avec S100A10, peut lier d’autres molécules telles que l’actine pour réguler la dynamique du cytosquelette et pour stabiliser les microdomaines membranaires riches en cholestérol. Elle se lie également à la cavéoline 1 pour réguler le transport de cholestérol, à la protéine AHNAK pour réguler les interactions cytosquelette – membranes.
Notes et références
- Gerke, V., Creutz, C. E. and Moss, S.E. (2005) Annexins: linking Ca2+ signalling to membrane dynamics. Nat.Rev.Mol.Cell Biol., 6, 449-461.
- Gerke, V. and Moss, S. E. (1997) Annexins and membrane dynamics. Biochim.Biophys.Acta, 1357, 129-154.
- Gerke, V. and Moss, S. E. (2002) Annexins: from structure to function. Physiol Rev., 82, 331-371.
- Gerke, V. (2001) Annexins And Membrane Organisation In The Endocytic Pathway. Cell Mol.Biol.Lett., 6, 204.
- Menke, M., Gerke, V. and Steinem, C. (2005) Phosphatidylserine Membrane Domain Clustering Induced by Annexin A2/S100A10 Heterotetramer. Biochemistry, 44, 15296-15303.
- Hayes, M. J., Rescher, U., Gerke, V. and Moss, S. E. (2004) Annexin-actin interactions. Traffic., 5, 571-576.
- Hayes, M. J., Shao, D., Bailly, M. and Moss, S. E. (2006) Regulation of actin dynamics by annexin 2. EMBO J., 25, 1816-1826.
Liens externes
- Portail de la biologie cellulaire et moléculaire
- Portail de la biochimie