Arséniure de zinc
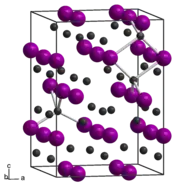
L'arséniure de zinc est un composé chimique de formule Zn3As2. Il se présente sous la forme d'un solide gris argenté semiconducteur II-V[3] ayant une largeur de bande interdite de 1,0 eV[4]. Il présente une structure cristalline téragonale centrée dans le groupe d'espace I41cd (no 110) avec les paramètres cristallins a = 1 178 pm et c = 2 364 pm. Les atomes de zinc occupent trois sites cristallographiques distoncts mais sont tous coordonnés aux atomes d'arsenic avec une géométrie tétraédrique tandis que les atomes d'arsenic sont coordonnés chacun à six atomes de zinc. Cette structure est très semblable à celle de l'arséniure de cadmium (en) Cd3As2, du phosphure de zinc Zn3P2 et du phosphure de cadmium (en) Cd3P2, le système quaternaire Zn-Cd-P-As (en) formant des solutions solides continues[5].
| Arséniure de zinc | |||
| |||
| __ Zn2+ __ As3− Structure cristalline de l'arséniure de zinc |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.031.338 | ||
| No CE | 234-486-2 | ||
| PubChem | 25147458 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide gris argenté[1] | ||
| Propriétés chimiques | |||
| Formule | As2Zn3 |
||
| Masse molaire[2] | 345,98 ± 0,06 g/mol As 43,31 %, Zn 56,7 %, |
||
| Propriétés physiques | |||
| T° fusion | 1 015 °C[1] | ||
| Masse volumique | 5,528 g·cm-3[1] à 20 °C | ||
| Précautions | |||
| SGH[1] | |||
  Danger |
|||
| NFPA 704[1] | |||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
D'autres structures sont observées à températures plus élevées[6], une seconde phase tétragonale à 190 °C et une troisième phase à 651 °C[7].
L'arséniure de zinc peut être obtenu en faisant réagir du zinc avec de l'arsenic sous atmosphère d'azote à 700 °C[6] :
Il se décompose sous l'action des acides en libérant de l'arsine AsH3[6] :
Dans l'industrie des semiconducteurs, l'arséniure de zinc est utilisé pour le dopage et la production d'arsine[8],[9].
Notes et références
- « Fiche du composé Zinc arsenide, 99.999% (metals basis) », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Edward D. Palik, Handbook of Optical Constants of Solids, Academic Press, 1998, p. 595. (ISBN 0-12-544423-0)
- (en) J. R. Botha, G. J. Scriven, J. A. A. Engelbrecht et A. W. R. Leitch, « Photoluminescence properties of metalorganic vapor phase epitaxial Zn3As2 », Journal of Applied Physics, vol. 86, no 10, , p. 5614-5618 (DOI 10.1063/1.371569, Bibcode 1999JAP....86.5614B, lire en ligne)
- (en) V. M. Trukhan, A. D. Izotov et T. V. Shoukavaya, « Compounds and solid solutions of the Zn-Cd-P-As system in semiconductor electronics », Inorganic Materials, vol. 50, , p. 868-873 (DOI 10.1134/S0020168514090143, lire en ligne)
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. I, 1975, p. 1033. (ISBN 3-432-02328-6)
- (en) H. Okamoto, « The As-Zn (arsenic-zinc) system », Journal of Phase Equilibria, vol. 13, , p. 155-161 (DOI 10.1007/BF02667479, lire en ligne)
- (en) Jeanne Mager Stellman, Encyclopaedia of Occupational Health and Safety: Chemical, industries and occupations, International Labour Organization, 1998, p. 83.24. (ISBN 92-2109816-8)
- (en) Anthony C. Jones et Michael L. Hitchman, Chemical Vapour Deposition: Precursors, Processes and Applications, Royal Society of Chemistry, 2009, p. 546. (ISBN 0-85404-465-5)
- Portail de la chimie

