Azéotrope
Un mélange azéotrope ou azéotropique (a privatif, du grec zêin bouillir et tropos manière de) est un mélange liquide qui bout à température fixe en gardant une composition fixe.
.png.webp)
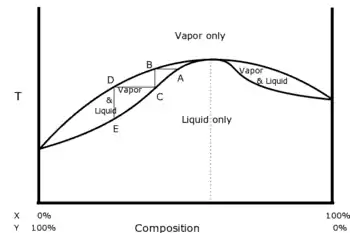
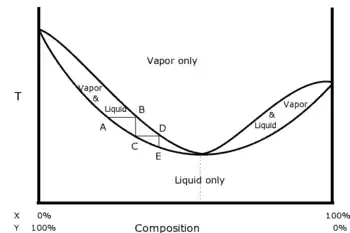
Un mélange azéotropique est un mélange qui présente, pour une composition particulière, une phase vapeur ayant la même composition que la phase liquide avec laquelle elle est en équilibre.
À pression donnée, quand on distille un mélange de deux liquides, la température d'ébullition n'est pas toujours comprise entre celles des deux constituants : elle peut présenter une température d'ébullition supérieure à la température d'ébullition des constituants purs (azéotropisme négatif) ou une température d'ébullition inférieure à la température d'ébullition des constituants purs (azéotropisme positif). Dans l'un et l'autre des cas, la distillation fractionnée ne permet pas de séparer les deux liquides, mais seulement l'un d'entre eux et le mélange azéotrope correspondant à la température d'ébullition maximale ou minimale.
Il ne peut y avoir un point azéotrope dans un diagramme binaire que pour des solutions non idéales (la loi de Raoult est formellement incapable de représenter un azéotrope) de liquides totalement miscibles. Dans ces solutions réelles les interactions entre 2 constituants A et B sont de natures différentes des interactions de type A - A ou de type B - B. Par exemple, à pression atmosphérique un mélange à 96 % d'éthanol et 4 % d'eau présente un azéotrope qui bout à 78,1 °C, température inférieure à celle de l'eau pure (100 °C) et de l'éthanol pur (78,4 °C). En pratique, une différence de température d'ébullition de 0,3 °C est difficile à exploiter.
En chimie organique et en chimie industrielle, on se sert des propriétés azéotropiques de certains solvants avec l'eau pour pouvoir l'extraire du milieu réactionnel (azéotrope toluène/eau, benzène/eau, notamment utilisés pour obtenir de l'éthanol absolu).
On peut citer quelques propriétés du point azéotrope :
- sa courbe d'analyse thermique est analogue à la courbe d'analyse thermique d'un corps pur ;
- la composition de l'azéotrope varie avec la pression ;
- le théorème de Gibbs-Konovalov permet de démontrer qu'en un point extremum d'un diagramme binaire isobare ou isotherme, les compositions de la phase liquide et de la phase vapeur en équilibre sont identiques (deuxième règle de Konovalov) ;
- deux composés ayant un point de Bancroft formeront un azéotrope, la réciproque n'étant pas vraie (tous les mélanges binaires formant un azéotrope n'ont pas nécessairement de point de Bancroft).
Notes
- (en) Ulrich K. Deiters et Thomas Kraska, High-Pressure Fluid Phase Equilibria : Phenomenology and Computation, Amsterdam/Boston, Elsevier, coll. « Supercritical Fluid Science and Technology », , 342 p. (ISBN 978-0-444-56347-7, ISSN 2212-0505, lire en ligne), p. 31.