Chromosome de Philadelphie
Le chromosome Philadelphie est une anomalie chromosomique acquise des cellules souches hématopoïétiques qui est associée à la leucémie myéloïde chronique (LMC). Aussi nommée t(9;22)(q34;q11), selon la nomenclature ISCN, le chromosome Philadelphie est le résultat d’une translocation réciproque (ou un échange de matériel génétique) entre les chromosomes 9 et 22 aboutissant à la fusion des gènes BCR (Breakpoint Cluster Region) et ABL1 (Abelson), ce qui forme le gène de fusion BCR-ABL1.
Pour les articles homonymes, voir PH (homonymie) et Philadelphie (homonymie).

| Spécialité | Oncologie |
|---|
| CISP-2 | B73 |
|---|---|
| CIM-10 | C92.1 |
| CIM-9 | 205.1 |
| ICD-O | 9875/3 |
| MeSH | D010677 |
![]() Mise en garde médicale
Mise en garde médicale
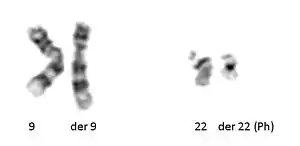
Cette anomalie a été décrite en 1960 par Peter Nowell (Université de Pennsylvanie) et David Hungerford (Fox Chase Cancer Center's Institute for Cancer Research). En 1973, Janet D. Rowley de l'Université de Chicago identifia les mécanismes aboutissant au chromosome Philadelphie.
La recherche de cette translocation par des techniques de cytogénétique et/ou de génétique moléculaire est désormais utilisée pour confirmer un diagnostic de LMC, et tout au long du suivi de la pathologie pour mesurer la réponse cytogénétique et détecter une éventuelle résistance ou rechute. Approximativement 95 % des personnes ayant développé la maladie sont porteuses de cette anomalie chromosomique. Chez 5 % des patients, le chromosome Philadelphie est absent et l'anomalie à l'origine de la formation de la protéine de fusion BCR-ABL1 est cryptique (non visible au caryotype) ou fait intervenir d'autres partenaires chromosomiques dans une translocation variante de la translocation classique.
Les techniques de cytogénétique (caryotype et hybridation in situ en fluorescence) permettent d'examiner avec précision les anomalies génétiques au niveau cellulaire. Elles doivent être complétées par des techniques de biologie moléculaire (PCR) qui augmentent la limite détection du réarrangement BCR-ABL1 (détection de taux extrêmement faibles), mais ne permettent pas d'étude globale du génome. La PCR est utilisée pour typer les transcrits BCR-ABL1 au diagnostic ainsi que pour quantifier la maladie résiduelle lors du suivi sous traitement.
Le chromosome Philadelphie peut également être retrouvé chez des patients atteints de Leucémie aiguë lymphoblastique (LAL, 25-30 % chez l’adulte et 2-10 % chez les enfants) et plus rarement de leucémie aigüe myéloblastique (LAM).
Biologie moléculaire
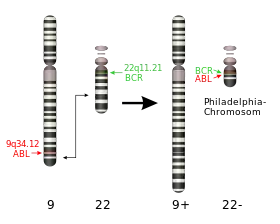
Comme dit précédemment, le chromosome Philadelphie résulte d'un remaniement chromosomique appelé translocation réciproque. Un segment des chromosomes 9 et 22 s'inter-changent et prennent la place l'un de l'autre. Ceci résulte en la fusion d’une partie du gène BCR (breakpoint cluster region) sur le chromosome 22 avec une partie du gène ABL1 (Abelson) sur le chromosome 9. La protéine de fusion issue de ce gène BCR-ABL1 est une protéine intracellulaire ayant une activité tyrosine kinase constitutionnelle dérégulée, contrairement celle de la protéine ABL1 normale. En fonction de la position exacte des points de cassure, le poids moléculaire de la protéine varie entre 185 et 210 kDa, constituant des isoformes distinctes avec des caractéristiques cliniques particulières. Les points de cassure peuvent entraîner des transcrits de fusion différents, dont des transcrits majeurs (Major-BCR-ABL1) qui représentent 95% des transcrits de fusions retrouvés et des transcrits mineurs (minor-BCR-ABL1).
La protéine hybride BCR-ABL1 est constitutivement active et ne requiert aucune activation par d'autres protéines cellulaires. Ceci a pour conséquence que de nombreuses protéines et enzymes contrôlant le cycle cellulaire sont à leur tour activées par BCR-ABL1, avec pour conséquence une augmentation de la prolifération cellulaire et une inhibition de l'apoptose. De plus, BCR-ABL1 inhibe la réparation de l'ADN, causant une forte instabilité génomique à l'origine de la crise blastique de la LMC qui en est l'évolution inéluctable si la maladie n'est pas traitée.
Traitement
L'Imatinib mesylate est un inhibiteur de tyrosine kinase qui a été découvert dans la fin des années 1990 par la firme pharmaceutique Novartis et s'est révélé être une molécule prometteuse contre certains cancers par son activité inhibitrice de la protéine BCR-ABL1. Des essais cliniques menés par les Dr Brian J. Druker en collaboration avec le Dr Charles Sawyers et Dr Moshe Talpaz ont montré que cette molécule stoppait la prolifération des cellules hématopoïétiques exprimant BCR-ABL1. Par conséquent, l'imatinib inhibe la croissance du clone malin et diminue considérablement le risque de crise blastique. L'imatinib est commercialisé par la firme pharmaceutique Novartis sous le nom de Glivec. D'autres inhibiteurs de la protéine de fusion BCR-ABL1 sont aujourd'hui disponibles, désignés comme inhibiteurs de 2ème (dasatinib, nilotinib et bosutinib) et 3e génération (ponatinib). Le dasatinib et le nilotinib disposent d'une autorisation de mise sur le marché en 1ère ligne et après résistance ou intolérance à l'imatinib alors que le bosutinib et le ponatinib ne peuvent être utilisés qu'en cas d'échec ou d'intolérance aux autres traitements. en 1ère ligne, leur efficacité biologique est supérieure à celle de l'imatinib, mais on ne dispose pas à ce jour d'argument sur leur supériorité en termes de survie globale et sans progression à long terme (le recul n'étant pas le même). L'efficacité de ces médicaments peut être réduite ou annulée par la présence de mutations au sein du domaine fonctionnel tyrosine kinase de ABL1, une des plus significatives étant la mutation gatekeeper T315I qui confère une résistance à l'imatinib et aux inhibiteurs de 2ème génération.
Notes et références
Voir aussi
Bibliographie
- R. Kurzrock, H. M. Kantarjian, B. J. Druker et M. Talpaz, « Philadelphia Chromosome-positive leukemias: from basic mechanisms to molecular therapeutics », Ann. Intern. Med., vol. 138, pages 819–830, 2003.
- P. Nowell et D. Hungerford, « A minute chromosome in chronic granulocytic leukemia », Science, vol. 132, page 1497, 1960.
- J. D. Rowley, « A new consistent chromosomal abnormality in chronic myelogenous leukaemia identified by quinacrine fluorescence and Giemsa staining », Nature, vol. 243, pages 290-293, 1973.
- Mendelian Inheritance in Man (OMIM) 608232, Mendelian Inheritance in Man (OMIM) 151410 (BCR), Mendelian Inheritance in Man (OMIM) 189980 (ABL)
- Melo JV, "BCR-ABL gene variants", Bailliers Clin Haematol, volume 10, pages 203-222, 1997.
Rosti G, Castagnetti F, Gugliotta G, Baccarani M.Tyrosine kinase inhibitors in chronic myeloid leukaemia: which, when, for whom? Nat Rev Clin Oncol. 2017 Mar;14(3):141-154.
- Portail de la médecine
- Portail de la biologie
- Portail de l’hématologie