Banksia cuneata
Banksia cuneata est une espèce d'arbrisseaux menacé de la famille des Proteaceae. Endémique du sud-ouest de l’Australie Occidentale, il appartient à Banksia subg. Isostylis, un sous-genre comprenant trois espèces de Banksia très proches les unes des autres, avec des inflorescences en forme de dôme plutôt que de cylindre, comme chez la plupart des autres espèces de Banksia. C’est un arbrisseau ou un petit arbre pouvant atteindre 5 m de haut. Son feuillage est piquant et ses fleurs sont roses et crème. L’espèce est pollinisée par des oiseaux de la famille des Meliphagidae.

| Règne | Plantae |
|---|---|
| Clade | Angiospermes |
| Clade | Dicotylédones vraies |
| Ordre | Proteales |
| Famille | Proteaceae |
| Genre | Banksia |
Bien que B. cuneata a été collectée pour la première fois avant 1880, il a fallu attendre 1981 pour que le botaniste australien Alex George décrive officiellement l’espèce et lui donne son nom. On observe deux populations distinctes au sein de l’espèce, mais qui ne sont pas pour autant reconnues comme des sous-espèces. Ce Banksia est considéré comme en danger d’extinction, car il ne reste que des fragments de populations dispersés dans les broussailles de sa région d’origine, qui a été défrichée à 93 % pour permettre le développement de l’agriculture. Comme Banksia cuneata est détruit par les feux de broussailles et se régénère à partir des graines qu’il disperse, la fréquence des incendies l’impacte fortement, et s’ils sont espacés de moins de quatre ans ils peuvent faire totalement disparaître l’espèce car les plantes ne sont pas encore assez matures pour produire des graines. Banksia cuneata est rarement cultivé, et son feuillage piquant limite son intérêt pour l’industrie de la fleur séchée.
Description

Banksia cuneata pousse sous la forme d'un buisson ou d'un petit arbre pouvant atteindre jusqu’à 5 m de haut. Il est dépourvu de lignotuber. Il a un ou plusieurs troncs principaux couverts d’une écorce grise et lisse. Les jeunes branches sont couvertes de poils, qui disparaissent au fil du temps. Les feuilles sont en forme de coin et ont une extrémité serretée, avec une à cinq dents le long de chaque côté. Elles mesurent 1 à 4 cm de long, pour 0,5 à 1,5 cm de large, avec un pétiole de 2 à 3 mm. La surface supérieure est vert terne, et la tige et les deux surfaces des jeunes feuilles sont couvertes de poils, qu’elles perdent rapidement[3].
Les fleurs forment des inflorescences en forme de dômes de 3 à 4 cm de diamètre, poussant à l’extrémité des branches. Ces inflorescences comprennent entre 55 et 65 fleurs, avec à leur base une couronne de courtes bractées. Comme chez d’autres Proteaceae, chaque fleur est composée d’un périanthe comprenant quatre tépales et un unique pistil, dont le style est initialement inséré dans le limbe du périanthe, mais s’en détache au moment de l’anthèse. Chez B. cuneata, le périanthe mesure 2,5 cm de long, avec un limbe d’environ 0,4 cm. Avant l’anthèse, le long et fin périanthe surmonté du limbe proéminent ressemble à une allumette. Au début, le périanthe est principalement couleur crème, devenant rose uniquement près de sa base, puis il devient entièrement rose. Le style initialement crème devient rouge, et le présentoir à pollen est vert[3].
Les fleurs fanent rapidement et tombent alors de l’inflorescence, laissant apparaître une base en bois dans laquelle sont insérés jusqu’à 5 follicules. Ils sont de couleur grise, lisses et couverts de petits poils fins, et mesurent 1 à 1,3 cm de haut, 1.7 à 2,1 cm le long de l’ouverture et 0.9 à 1,2 cm perpendiculairement à l’ouverture. Chaque follicule contient une ou deux graines triangulaires équipées d’une longue ailette[3].
Banksia cuneata est facile à distinguer des deux autres espèces du sous-genre B. subg. Isostylis du fait de ses fleurs plus vivement colorées et de ses feuilles plus ternes[3]. Il diffère par ailleurs de B. ilicifolia par sa plus petite taille, son écorce lisse, ses feuilles ses fleurs et ses fruits plus petites, et le changement de coloration de ses fleurs[4]. Les feuilles, fleurs et fruits de B. oligantha sont encore plus petits[3], et son feuillage est moins piquant que celui de B. cuneata[5].
Taxinomie
Découverte et étymologie

Le premier spécimen collecté de B. cuneata connu l’a été par Julia Wells un peu avant 1880. Celui qui deviendra par la suite l’holotype pour cette espèce a été collecté par le botaniste australien expert en Banksia Alex George le 20 novembre 1971, dans la Badjaling Nature Reserve, environ 8 km à l’est de Quairading[6]. L’espèce a finalement été publiée par George près de 10 ans plus tard, dans son ouvrage de 1981 The Genus Banksia L.f. (Proteaceae). Le nom spécifique de l’espèce vient du latin cuneatus (« en forme de coin »), en référence à la forme de ses feuilles[4].
L’histoire de la classification de l’espèce n’est pas marquée par des évènements particuliers. Elle n’a pas de synonyme et aucune sous-espèce ou variété connue[7].
Classification
George a placé B. cuneata dans le sous-genre Isostylis du fait de la forme de dôme de la tête de ses fleurs[4]. L’analyse cladistique réalisée en 1996 par les botanistes Kevin Thiele et Pauline Ladiges n’apporte aucune information sur les limites du sous-genre B. subg. Isostylis, ni les relations en son sein, donc la classification de George sur cette espèce a été retenue par ces deux botanistes[8]. La nouvelle classification n’a pas été acceptée par George et il la discrédita dans sa classification de 1999. B. cuneata n’est toutefois pas affecté, et on peut résumer son emplacement de la manière suivante[3] :
- Banksia
- B. subg. Banksia (3 sections, 11 séries, 73 espèces, 11 sous-espèces, 14 variétés)
- B.subg. Isostylis
- B. ilicifolia
- B. oligantha
- B. cuneata
Depuis 1998, le botaniste américain Austin Mast publie les résultats d’une analyse cladistique s’appuyant sur les données issues de l’ADN des différentes espèces de la sous-tribu des Banksiinae, qui comprend les genres Banksia et Dryandra. Ces analyses concluent à une phylogénie bien différente de celle de George. Banksia cuneata y est placé comme étant le plus proche parent d'un clade comprenant B. ilicifolia et B. oligantha, suggérant que le sous-genre B. subg. Isostylis dans lequel il est placé est monophylétique ; mais le clade apparait comme peu différencié, car ayant divergé relativement récemment, ce qui suggère que B.subg. Isostylis ne mérite peut-être pas le rang de sous-genre[9],[10],[11].
En 2007, Mast et Thiele proposent une nouvelle classification du genre Banksia en le fusionnant avec le genre Dryandra, et créent le sous-genre B. subg. Spathulatae pour regrouper les espèces ayant des cotylédons en forme de cuillère ; tandis que B. subg. Banksia regroupe les espèces n’ayant pas les cotylédons en forme de cuillère. Ils annoncent la publication prochaine d’une classification complète lorsque l’analyse d’ADN des espèces de Dryandra sera terminée ; dans le même temps, si les changements de nomenclature sont utilisés comme classification temporaire, B. cuneata est placé dans le sous-genre B. subg. Banksia[12].
Phylogénie
Les parentés entre B. cuneata et les autres membres de B. subg. Isostylis restent mal connues. Bien que les études de Mast ont montré que B. cuneata est la plus basale des trois espèces[10], une étude de 2004 sur la divergence génétique au sein de ce sous-genre a conclu à deux possibilités : certaines analyses suggèrent que B. ilicifolia est basale, tandis que d’autres suggèrent que c’est B. oligantha. Pour compliquer encore la situation, la population la plus au sud de B. cuneata montre des ressemblances génétiques et phénotypiques avec B. oligantha que l’on trouve au sud-est de l’Australie. L’origine de cette population est inconnue. Elle pourrait être issue d’hybridation entre les deux espèces, ou pourrait constituer une forme transitoire ou même un ancêtre de ces espèces. Finalement, des éléments de biogéographie laissent à penser que B. ilicifolia est l’espèce la plus basale parmi les trois : on la rencontre dans la High Rainfall Zone où les espèces les plus anciennes sont communes, tandis que les autres espèces vivent dans la Transitional Rainfall Zone, où les espèces ayant évolué plus récemment sont plus communes[13].
Distribution et habitat
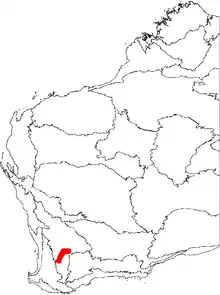
Espèce menacée, B. cuneata vit seulement dans une aire de 90 km autour de Pingelly et Quairading, en Australie Occidentale. Cette espèce affectionne surtout les sols sableux profonds à une altitude comprise entre 230 et 300 m, dans un habitat boisé[14]. Elle pousse souvent en association avec Banksia prionotes et Xylomelum angustifolium[4].
Le chiffrage de la taille des populations varie fortement d’une étude à l’autre. Ainsi, une enquête de 1982 reporte 450 plantes au sein de cinq peuplements, le plus grand comprenant 300 plantes. Cependant, en 1988, on ne trouve que 4 populations avec un total de 300 plantes ; étonnamment, seulement 50 spécimens sont observés dans la population où l’on en avait recensé 300 précédemment, alors qu’on a observé aucun arbuste mort ni aucune perturbation dans l’habitat[15]. Depuis les diverses études ont recensé entre 6[16],[17] et 11 populations avec un nombre total d’arbustes compris entre 340[18] et 580[19].
Écologie et cycle de vie

Principalement pollinisées par les oiseaux méliphages[21], les inflorescences sont visibles de septembre à décembre[22]. L’arbuste se caractérise par ses fleurs bien visibles en position terminale des branches, de couleur rouge ou rose, et présentant un style droit et un périanthe tubulaire. Toutes ces caractéristiques facilitent la pollinisation par les oiseaux[20].
La structure de la fleur de B. cuneata, avec l’extrémité du style fonctionnant comme un présentoir à pollen, suggère que la reproduction autogame est commune chez cette espèces. Par contre, cette possibilité est un peu réduite par sa protandrie : le pollen est relâché bien avant que le pistil ne soit réceptif ; ainsi généralement quand les pistils deviennent réceptifs une bonne partie du pollen a déjà quitté les étamines, ou a perdu de sa viabilité. Cette stratégie est efficace pour éviter qu’une même fleur ne se fertilise elle-même, mais n’empêche pas la géitonogamie, c’est-à-dire la fertilisation des fleurs par d’autres fleurs de la même plante. Du fait de la façon dont les fleurs sont positionnées les unes par rapport aux autres à l’extrémité des branches, ce cas doit être assez fréquente : même si la possibilité de donner par la suite un fruit viable est une autre question[16] : des études portant sur les isoenzymes ont noté une « forte sélection contre les homozygotes » chez cette espèce, une méthode de reproduction commune chez les plantes ayant une stratégie de reproduction basée sur la production de nombreuses graines[23].
L’étude du système de reproduction de cette espèce a montré que le taux de consanguinité était très variable d’une population à l’autre. Les populations vivant dans des broussailles intactes ont de fort taux de croisement et une consanguinité faible, mais celles que l’on trouve dans des environnements plus perturbés (ayant subi un incendie récemment…) sont nettement plus consanguines en moyenne. On peut expliquer cela par différentes hypothèses. Tout d’abord, la plus forte densité des populations dans les environnements perturbés conduit a des plus grands taux de fécondation entre plantes voisines. Ensuite, ces populations n’ont généralement pas de sous-bois, et ne peuvent donc pas abriter d’importantes populations d’oiseaux méliphages ; elles s’appuient plus sur des visiteurs occasionnels pour assurer leur pollinisation. Le taux de pollinisation fortement réduit engendre des niveaux de croisement moindre, ce qui mène à une moindre sélection naturelle contre les fertilisations consanguines ; et la présence sporadique de pollinisateurs rend les croisements plus variables[16],[24].
Il n’y a pas formation de graines s’il n’y a pas d’intervention de pollinisateurs, comme l’ont montré certaines expériences. Environ 96 % des follicules fertilisés arrivent à maturité, et environ 82 % des graines parviennent à ce stade. Ces chiffres sont très élevés parmi les Banksia, ce qui indique qu’il ne doit pas y avoir de problème d’approvisionnement en nutriments. Cette espèce produit un nombre inhabituellement élevé d’inflorescences, qui forment des cônes quand elles fanent, par plante — en général plus de 500. Toutefois il y a un nombre faible de follicules par cône – souvent un seul. Ainsi le nombre de follicules par plantes est sensiblement identique à ce que l’on peut voir chez les autres espèces de Banksia[18].
Banksia cuneata n’a pas de lignotuber, donc les plantes sont tuées par les feux de broussailles. Toutefois, cette espèce est fortement sérotinique : ses graines ne sont relâchées qu’à la suite d’un incendie. Ces plantes accumulent des graines dans sa canopée entre deux feux de broussaille, qui sont ensuite relâchées toutes à la fois après l’incendie, assurant la régénération de la population. Pour cela une résine scelle les follicules, prévenant leur déhiscence ; la chaleur du feu fait fondre la résine, et donc ouvrir les follicules. Des incendies intenses conduisent à la libération immédiate des graines et des éléments ligneux qui les séparent, mais après des feux moins intenses, le séparateur de graines reste en place, empêchant l’ouverture du follicule et donc la sortie de la graine. Les ailettes du séparateur de graines sont hygroscopique ; elles s’étirent sous l’effet de l’humidité, puis se rétractent quand elles sèchent. Elles s’ouvrent ainsi elles-mêmes, et les graines, libérées des follicules à la suite d'un cycle de plusieurs averses, sont assurées de trouver suffisamment d’humidité et des conditions favorables pour germer[18]. B. cuneata reste sous la forme d’une plantule environ quatre ans. Les populations sont très sensibles au feu durant cette période, puisqu’un incendie éradiquerait toute la population, sans qu’aucune graine ne soit libérée pour assurée le maintien du peuplement[18]. D’après certains modèles, l’intervalle optimal entre deux incendies pour maximiser la taille de la population à moyen terme serait de 15 ans. Des incendies plus fréquents handicapent la population en brulant des arbustes adultes avant qu’ils n’aient le temps d’atteindre leur pleine fécondité. Des incendies moins fréquents sont préjudiciables car ils donnent moins d’opportunités à la dispersion des graines. Toutefois l’intervalle optimal entre deux incendies pour permettre d’éviter le risque d’extinction à long terme est certainement plus long[23].

B. cuneata a la caractéristique d’être très peu sujet aux pertes de graines liées à leur consommation par des granivores. Dans presque toutes les espèces apparentées, des larves d’insectes consomment une large majorité des graines, et les oiseaux causent des pertes supplémentaires en cassant les cônes ouverts à la recherche de larves. Les insectes consommateurs de graines sont souvent très spécialisés et spécifiques à une espèce, et il semble qu’il n’y ait aucun insecte spécifiquement adapté à B. cuneata. Des raisons pouvant expliquer cela sont le petit nombre de graines relâchées et la rareté de l’espèce. On en connait pas non plus d’animaux consommant les graines une fois au sol[18]. Ainsi, cette espèce a le plus grand taux de viabilité des graines enregistrée parmi les espèces de Banksia : dans une étude, 74 % de toutes les graines produites dans les 12 années précédentes se sont révélées viables. C’est encore plus net pour les graines de moins de 9 ans, parmi lesquelles 90 % demeurent viables. Après 9 ans la viabilité baisse rapidement du fait de la sénescence des follicules[18]. La production de graines elle-même commence très lentement. En moyenne, les plantes âgées entre 5 et 12 ans ont environ 18 graines stockées dans leur canopée. Ce stock augmente exponentiellement toutefois, et les arbustes de 25 ans portent souvent des dizaines de milliers de graines. La production de graines ne se stabilise jamais. En fait, lorsqu’un arbuste a atteint l’âge de 20 ans, il a accumulé un tel poids de cônes sur ces branches que les plus grandes d’entre elles commencent à casser sous leur propre poids, et à l’âge de 30 ans l’arbuste perd une majorité de ses branches de cette manière. Au fur et à mesure des années, les branches craquent irrémédiablement, ce qui conduit à la sénescence de la plante, qui dépasse rarement l’âge de 45 ans[18],[25].
Les forts taux de maturation et viabilité des graines sont contrebalancés par le très faible taux de survie des plantules. Ce dernier est presque entièrement lié au stress hydrique. Dans une étude, environ 17 100 graines viables ont été relâchées à la suite d'un incendie créé artificiellement. Moins de 5 % d’entre elles ont germé convenablement, et seulement 11 plantes ont survécu à la sècheresse du premier été. Les dernières plantules à disparaître étaient situées dans des trous, des zones ombragées ou dans des litières de feuilles, et les onze survivantes étaient placées sur la bordure de la route, où elles bénéficiaient de l’écoulement d’eau de la route ainsi que d'un paillis constitué d'une couche de 3 cm de latérite pisolithique. La survie des plantes semblent donc liée à la disponibilité en eau[18].
Sauvegarde
Banksia cuneata a été placée parmi les espèces en danger critique d’extinction par l’UICN après une étude de 1982 qui n’a recensé que 5 populations encore survivantes comprenant en tout 450 arbustes. Le plus gros peuplement, comprenant environ 300 plantes, était situé dans une réserve naturelle, mais les quatre autres étaient situées le long des routes et comprenaient chacune 50 à 70 arbustes. Toutefois, depuis que d’autres peuplements ont été localisés, et que la population s’est révélée en augmentation grâce à diverses mesures de conservation comme la pose de clôture et le piégeage des lapins, l’espèce est considérée comme menacée.
En avril 1987, le Department of Environment and Conservation d’Australie Occidentale brûle une partie d’un peuplement lors d’un incendie de régénération expérimental. Les plantes matures furent anéanties, et les plantules qui ont repoussé spontanément n’ont pas survécu à la sècheresse estivale[18]. Un groupe veillant à la sauvegarde de l’espèce, la Matchstick Banksia Recovery Team, est établie en 1995, et au fil du temps parvient à établir un grand nombre de jeunes plantules[19]. Une grande population adulte a été détruite dans un incendie en 1996, causant diverses inquiétudes, mais il a été suivi par l’émergence d’un grand nombre de jeunes plantes[26].
Les menaces planant sur B. cuneata comprennent la déforestation, qui conduit à la perte directe de plantes et à la fragmentation des habitats, la pression de pâturage, la compétition par des plantes non endémiques, les rythmes variables des incendies et l’augmentation de la salinité des sols[27],[28]. L’étude « The Banksia Atlas » a trouvé une population sur le bord d’une route, comprenant uniquement des plantes vieillissantes et aucune jeunes pousses, et le site étant infesté d’autres plantes envahissantes[14]. La plupart des populations persistantes sont localisées sur des terrains privés, et leur survie dépend donc de la bonne volonté des propriétaires. Certains d’entre eux ont clôturé ces zones et empêchent que les lapins y aient accès. Il y a eu quelques tentatives du CALM pour déplacer des populations dans diverses autres zones, avec un certain succès à condition que les plantes soient arrosées la première année[5].
Défrichage des terres
Avant même que la Wheatbelt ne soit défrichée dans les années 1930, B. cuneata devait avoir une distribution très fragmentée, car les sols profonds de sable jaune dans lesquels on trouve cette espèce sont présents par patchs clairsemés, et ne représente que 10 à 15 % de la région. Environ 93 % des terres ont depuis été défrichées de leur végétation primitive, pour faire place à l’agriculture notamment, et les 7 % restant forment des ensembles de différentes tailles. Le défrichage a ainsi conduit à fragmenter encore plus une population qui l’était déjà nettement, et à fortement réduire le nombre d’individus la composant[16],[21].
Sauvegarde de la diversité génétique

Les degrés de diversité génétique au sein des populations de B. cuneata sont inhabituellement hauts pour une espèce rare et menacée[29], mais les populations peuvent être regroupées en deux groupes génétiques distincts. Ils ne sont pas séparés géographiquement par une grande distance mais par la Salt River, une rivière saline éphémère qui rend l’habitat inhabitable pour B. cuneata et les oiseaux qui pollinisent cette espèce. La rivière fonctionne ainsi comme une barrière aux échanges génétiques, conduisant à la divergence progressive des deux populations. Les efforts de sauvegarde doivent être conduits des deux côtés de la rivière pour préserver la plus grande diversité génétique possible[16],[21],[30],[31]. Plus récemment, un modèle d’analyse de risque a estimé que la taille de la population idéale pour réduire les risques d’extinction de l’espèce à des niveaux acceptables était de dix fois la taille de la population actuelle. Cela conduit à penser que chaque population et chaque habitat convenable doivent être protégés[17].
Maladie
Le dépérissement causé par Phytophthora cinnamomi n’est pas considéré comme une menace pour cette espèce, mais des tests ont révélé qu’elle y était tout de même sensible[32]. Ainsi dans une étude portant sur 49 espèces de Banksia, elle s’est montrée l’espèce la plus sensible, 80 % des plantes mourant dans les 96 jours suivant l’inoculation de la maladie, et la totalité des plantes étant mortes en moins d’un an[33].
Changement climatique
La survie de cette espèce est étroitement liée aux précipitations du fait de la sensibilité des jeunes pousses à la sècheresse. Cette espèce est donc inquiétée par le changement climatique. Cela est reconnu depuis 1992, quand il a été démontré que la pluviométrie hivernale dans la région de Quairading avait baissé d'environ 4 % par décennie, et si cette tendance se poursuit cela pourrait réduire la distribution de l’espèce[25]. Récemment, une étude plus approfondie sur l’impact potentiel du changement climatique sur cette espèce a conclu que des changements importants pourraient conduire à l’extinction de l’espèce, et sa répartition géographique pourrait se réduire de 80 % d’ici 2080. Toutefois, si les modifications climatiques sont moins importantes, la distribution de l’espèce ne diminuerait pas, tout cela dépendant de l’efficacité avec laquelle cette espèce pourra migrer dans de nouveaux habitats convenables[34].
Utilisation
Culture
La propagation de l’espèce se fait par graines, bien que celles-ci sont dures à obtenir[22]. Les graines n’ont besoin d’aucun traitement particulier avant d’être semées, et prennent environ 23 jours à germer[35]. Le bouturage a des résultats très irréguliers[22]. La plante elle-même préfère un sol profond, sableux et bien drainé, avec un pH compris entre 6 et 7. Elle a besoin d’être en plein soleil, mais une protection contre le vent est recommandée, car cette plante grandit vite et ses longues branches sont sensibles au vent. On peut obtenir un arbuste plus compact en élaguant le quart supérieur de la plante tous les ans[22],[36]. Cette espèce a un intérêt mineur pour l’industrie des fleurs coupées, du fait de son feuillage épineux[22] et sa tendance à faire goutter son nectar.
Ironiquement, étant donné son statut de sauvegarde, Kingsley Dixon, du Kings Park and Botanic Garden, considère que cette espèce peut devenir envahissante, des arbustes ayant été plantés au nord de Moore River pour fournir des plantes aromatiques, et des plantules ont été observés par la suite[5].
Références culturelles
Banksia cuneata a été adopté comme emblème du Comté de Quairading, et est représenté sur le logo de cette région. Il existe un parc nommé Cuneata Park dans la ville de Quairading[5].
Notes et références
- IPNI. International Plant Names Index. Published on the Internet http://www.ipni.org, The Royal Botanic Gardens, Kew, Harvard University Herbaria & Libraries and Australian National Botanic Gardens., consulté le 13 juillet 2020
- The Plant List (2013). Version 1.1. Published on the Internet; http://www.theplantlist.org/, consulté le 29 mai 2017
- (en) Alex S. George, « Banksia », Flora of Australia, CSIRO Publishing / Australian Biological Resources Study, vol. 17B, , p. 175–251 (ISBN 0-643-06454-0).
- (en) Alex George, « The Genus Banksia L.f. (Proteaceae) », Nuytsia, vol. 3, no 3, , p. 239–473.
- (en) K. Kershaw et C. Liber, « Threatened Banksias #4 & #5: Banksia cuneata & B. oligantha », Threatened Banksias #4 & #5: Banksia cuneata & B. oligantha, vol. 5, no 3, , p. 1–5 (ISSN 1444-285X).
- (en) « Banksia cuneata A.S.George », sur Australian National Herbarium Specimen Information Register (ANHSIR) (consulté le ).
- (en)« 'Banksia cuneata A.S.George », Australian Plant Name Index (APNI), IBIS database, Centre for Plant Biodiversity Research, Australian Government.
- (en) Kevin Thiele et Pauline Y. Ladiges, « A cladistic analysis of Banksia (Proteaceae) », Australian Systematic Botany, vol. 9, no 5, , p. 661–733 (DOI 10.1071/SB9960661).
- (en) Austin R. Mast, « Molecular systematics of subtribe Banksiinae (Banksia and Dryandra; Proteaceae) based on cpDNA and nrDNA sequence data: implications for taxonomy and biogeography », Australian Systematic Botany, vol. 11, , p. 321–342 (DOI 10.1071/SB97026).
- (en) Austin R. Mast et Thomas J. Givnish, « Historical biogeography and the origin of stomatal distributions in Banksia and Dryandra (Proteaceae) based on Their cpDNA phylogeny », American Journal of Botany, vol. 89, no 8, , p. 1311–1323 (ISSN 0002-9122, DOI 10.3732/ajb.89.8.1311, lire en ligne, consulté le ).
- (en) Austin R. Mast, Eric H. Jones et Shawn P. Havery, « An assessment of old and new DNA sequence evidence for the paraphyly of Banksia with respect to Dryandra (Proteaceae) », Australian Systematic Botany, CSIRO Publishing / Australian Systematic Botany Society, vol. 18, no 1, , p. 75–88 (DOI 10.1071/SB04015).
- (en) Austin R. Mast et Thiele Kevin, « The transfer of Dryandra R.Br. to Banksia L.f. (Proteaceae) », Australian Systematic Botany, vol. 20, , p. 63–71 (DOI 10.1071/SB06016).
- (en) Linda M. Broadhurst et David J. Coates, « Genetic divergence among and diversity within two rare Banksia species and their common close relative in the subgenus Isostylis R.Br. (Proteaceae) », Conservation Genetics, vol. 5, , p. 837–846 (DOI 10.1007/s10592-004-5268-9).
- (en) Anne Taylor et Stephen Hopper, The Banksia Atlas (Australian Flora and Fauna Series Number 8), Canberra, Australian Government Publishing Service, , 258 p. (ISBN 0-644-07124-9).
- (en) Stephen Connell, Byron Lamont et Stephen Bergl, « Rare & Endangered: Matchstick Banksia », Australian Natural History, vol. 22, no 8, , p. 354–355.
- D. J. Coates et R. E. S. Sokolowski, « The mating system and patterns of genetic variation in Banksia cuneata A.S.George (Proteaceae) », Heredity, vol. 69, , p. 11–20 (DOI 10.1038/hdy.1992.89).
- (en) Mark Burgman et al., « A method for setting the size of plant conservation target areas », Conservation Biology, vol. 15, no 3, , p. 603–616 (DOI 10.1046/j.1523-1739.2001.015003603.x).
- (en) Byron B. Lamont et al., « Seed bank and population dynamics of Banksia cuneata: The role of time, fire and moisture », Botanical Gazette, vol. 152, no 1, , p. 114–22 (DOI 10.1086/337870, lire en ligne).
- (en) Jackie Nichol, Successful re-establishment of matchstick banksia, CALMnews, novembre–décembre 1997, p. 11.
- (en) HA Ford, DC Paton et N Forde, « Birds as pollinators of Australian plants », New Zealand Journal of Botany, vol. 17, , p. 509–19.
- J. F. Sampson et al., Gondwanan heritage : past, present and future of the Western Australian biota, Chipping Norton, Surrey Beatty & Sons, , 187–195 p., « Mating system variation in animal-pollinated rare and endangered plant populations in Western Australia ».
- (en) Kevin Collin et al., Banksias, Melbourne, Victoria, Bloomings Books, , 376 p. (ISBN 978-1-876473-68-6).
- (en) M. A. Burgman, S Ferson et H. R. Akçakaya, Risk assessment in conservation biology, Londres, Chapman and Hall, coll. « Population and community biology series 12 », , 314 p. (ISBN 0-412-35030-0, présentation en ligne), « 6.4: A stochastic model for Banksia cuneata ».
- (en) David J. Coates, Jane F. Sampson et Colin J. Yates, « Plant mating systems and assessing population persistence in fragmented landscapes », Australian Journal of Botany, vol. 55, , p. 239–249 (DOI 10.1071/BT06142).
- (en) Mark Burgman et Byron Lamont, « A stochastic model for the viability of Banksia cuneata populations: environmental, demographic and genetic effects », Journal of Applied Ecology, vol. 29, no 3, , p. 719–27 (DOI 10.2307/2404481, lire en ligne).
- (en) Jackie Nichol, « Rare plants' regrowth out of Quairading wildfire », CALMnews, novembre–décembre 1997, p. 7.
- (en) Brett Beecham, « Avon Wheatbelt 1 (AW1 – Ancient Drainage subregion) », sur A Biodiversity Audit of Western Australia's 54 Biogeographical Subregions in 2002, Department of Conservation and Land Management, Western Australian Government (consulté le ).
- (en) Brett Beecham, « Avon Wheatbelt 2 (AW2 – Re-juvenated Drainage subregion) », sur A Biodiversity Audit of Western Australia's 54 Biogeographical Subregions in 2002, Department of Conservation and Land Management, Western Australian Government (consulté le ).
- (en) Tina L. Maguire et Margaret Sedgley, « Genetic diversity in Banksia and Dryandra (Proteaceae) with emphasis on Banksia cuneata, a rare and endangered species », Heredity, vol. 79, no 4, , p. 394–401 (DOI 10.1038/hdy.1997.173, lire en ligne).
- (en) S. D. Hopper et D. J. Coates, Australian ecosystems : 200 years of utilisation, degradation and reconstruction, coll. « Proceedings of the Ecological Society of Australia 16 », , 567–577 p., « Conservation of genetic resources in Australia's flora and fauna ».
- (en) David J. Coates, « Defining conservation units in a rich and fragmented flora: implications for the management of genetic resources and evolutionary processes in south-west Australian plants », Australian Journal of Botany, vol. 48, , p. 329–339 (DOI 10.1071/BT99018).
- « Part 2, Appendix 4: The responses of native Australian plant species to Phytophthora cinnamomi » [PDF], sur Management of Phytophthora cinnamomi for Biodiversity Conservation in Australia, Department of the Environment and Heritage, Australian Government, (consulté le ).
- (en) Thomas A. McCredie et al., « Variability in the resistance of Banksia L.f. species to Phytophthora cinnamomi Rands », Australian Journal of Botany, vol. 33, no 6, , p. 629–37 (DOI 10.1071/BT9850629).
- (en) Matthew C. Fitzpatrick et al., « Climate change, plant migration, and range collapse in a global biodiversity hotspot: the Banksia (Proteaceae) of Western Australia », Global Change Biology, vol. 14, , p. 1–16 (DOI 10.1111/j.1365-2486.2008.01559.x).
- (en) Luke Sweedman et al., Australian seeds : a guide to their collection, identification and biology, CSIRO Publishing, (ISBN 0-643-09298-6), p. 203.
- (en) Alex S. George, The Banksia Book, Kenthurst, Nouvelle-Galles du Sud, Kangaroo Press (in association with the Society for Growing Australian Plants), , 3rd éd., 240 p. (ISBN 0-86417-818-2), p. 116.
Liens externes
- (en) Référence IPNI : Banksia cuneata
- (en) Référence Fonds documentaire ARKive : Banksia cuneata (consulté le )
- (en) Référence JSTOR Plants : Banksia cuneata (consulté le )
- (en) Référence BioLib : Banksia cuneata A.S. George (consulté le )
- (en) Référence Catalogue of Life : Banksia cuneata A. S. George (consulté le )
- (fr) Référence CITES : taxon Banksia cuneata (sur le site du ministère français de l'Écologie) (consulté le )
- (en) Référence NCBI : Banksia cuneata (taxons inclus) (consulté le )
- (en) Référence The Plant List : Banksia cuneata A.S.George (source : KewGarden WCSP) (consulté le )
- (en) Référence Tropicos : Banksia cuneata A.S. George (+ liste sous-taxons) (consulté le )
- (en) Référence uBio : Banksia cuneata A.S.George (consulté le )
- Portail de la botanique
- Portail de l’Australie