Base de Lewis
Une base de Lewis (du nom du chimiste américain Gilbert Newton Lewis) ou nucléophile est une entité chimique dont un des constituants possède un doublet ou plus d'électrons libres ou non liants sur sa couche de valence. Elles peuvent former des liaisons covalentes coordonnées avec un acide de Lewis. Une telle espèce est représentée en représentation de Lewis par un trait sur l'atome concerné.
Exemples
Exemples typiques :
- les composés de azote (N), phosphore (P), arsenic (As), antimoine (Sb) et bismuth (Bi) au degré d'oxydation 3 ;
- les composés de oxygène (O), soufre (S), sélénium (Se) et tellure (Te) au degré d'oxydation 2, incluant l’eau, les éthers, les cétones, les composés sulfoxydes ;
- des molécules comme le monoxyde de carbone.
Exemples spécifiques :
Ion hydroxyde :
Ion éthanolate :
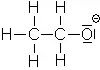
Ammoniac :

Ion fluorure :
![]()
Réactivité
La réaction entre une base et un acide de Lewis forme un adduit de Lewis. Les doublets non liants de la base de Lewis viennent combler les lacunes des couches de valence des acides de Lewis.
Exemple : formation d'un adduit de Lewis entre l'éthoxyéthane et un organomagnésien mixte :
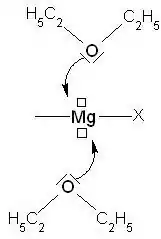 ⇒
⇒ 
Basicité au sens de Brönsted
Une base selon le chimiste suédois Johannes Nicolaus Brönsted est une espèce chimique susceptible de capter un proton H+. Il s'agit d'un cas particulier de la théorie de Lewis où, en solution aqueuse, le proton H+ joue le rôle d'acide de Lewis.
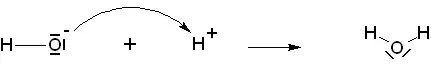
Voir aussi
- Portail de la chimie