Benzoïne
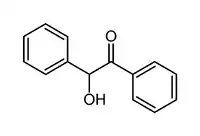
La benzoïne est un composé organique de la classe des acyloïnes et de formule semi-développée PhCH(OH)C(O)Ph avec Ph = phényl. Elle consiste en un pont éthylène substitué par deux groupes phényle et possédant une fonction alcool en alpha d'une fonction cétone. Elle se présente sous la forme d'une poudre cristalline, blanche à jaunâtre, avec une légère odeur de camphre.
| Benzoïne | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2-hydroxy-1,2-di(phényl)éthanone | |
| Synonymes |
α-hydroxy-α-phénylacétophénone |
|
| No CAS | (R/S) ((R)-(–)) ((S)-(+)) |
|
| No ECHA | 100.003.938 | |
| No CE | 204-331-3 | |
| PubChem | 8400 | |
| SMILES | ||
| InChI | ||
| Apparence | poudre cristalline blanche à jaunâtre, odeur aromatique[1] | |
| Propriétés chimiques | ||
| Formule | C14H12O2 [Isomères] |
|
| Masse molaire[2] | 212,243 9 ± 0,012 6 g/mol C 79,23 %, H 5,7 %, O 15,08 %, |
|
| Propriétés physiques | ||
| T° fusion | 132 à 134 °C (racémique)[1] 135 à 137 °C énantiomères R et S[3],[4] |
|
| T° ébullition | 344 °C[1] | |
| Solubilité | 0,3 g·l-1 (eau, 25 °C)[1] | |
| Masse volumique | 1,3 g·cm-3 à 20 °C[1] | |
| T° d'auto-inflammation | 182 °C[1] | |
| Point d’éclair | 182 °C[1] | |
| Pression de vapeur saturante | 1,3 mbar à 136 °C[1] | |
| Précautions | ||
| NFPA 704 | ||
| Écotoxicologie | ||
| DL50 | > 3 g·kg-1 (souris, oral)[5] 10.000 mg/kg (rat, oral)[1] 8.870 mg·kg (lapin, dermal)[1] |
|
| LogP | 2,13[1] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Stéréochimie
L'atome de carbone portant le groupe hydroxyle est asymétrique. La benzoïne se présente donc sous la forme d'une paire d'énantiomères :
- (R)-(–)-benzoïne, de numéro CAS
- (S)-(+)-benzoïne, de numéro CAS
Les deux énantiomères ont chacun une activité optique égale à −115° (c = 1,5 in acétone) pour le (R)-(–)[3] et +115° (c = 1,5 in acétone) pour le (S)-(+)[4].
Histoire
La benzoïne a été obtenu pour la première fois en 1832 par Justus von Liebig et Friedrich Wöhler lors de leurs recherches sur l'huile d'amande amère qui est principalement du benzaldéhyde avec des traces d'acide cyanhydrique, HCN[6]. Cette synthèse catalytique de la benzoïne a été améliorée par Nikolay Zinin pendant la même période avec Liebig[7],[8].
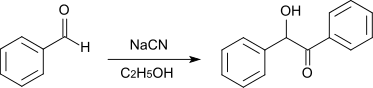
Synthèse
La benzoïne est synthétisée à partir du benzaldéhyde par une addition catalysée par du cyanure dans l'éthanol (condensation benzoïnique)[9] :
Utilisation
Le principal usage de la benzoïne est celui de précurseur du benzile qui est un photoinitiateur (en)[10]
Notes et références
- Entrée « Benzoin » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 juin 2010 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé (R)-(−)-Benzoin, consultée le 12/06/2010.
- Fiche Sigma-Aldrich du composé (S)-(+)-Benzoin, consultée le 12/06/2010.
- Iyakuhin Kenkyu. Study of Medical Supplies. Vol. 15, Pg. 359, 1984.
- Wöhler, Liebig, Untersuchungen über das Radikal der Benzoesäure, Annalen der Pharmacie, 1832, vol. 3(3), p. 249–282. DOI:10.1002/jlac.18320030302.
- N. Zinin, Beiträge zur Kenntniss einiger Verbindungen aus der Benzoylreihe, Annalen der Pharmacie, 1839, vol. 31(3), p. 329–332. DOI:10.1002/jlac.18390310312.
- N. Zinin, Ueber einige Zersetzungsprodukte des Bittermandelöls, Annalen der Pharmacie, 1840, vol. 34(2), p. 186–192.DOI:10.1002/jlac.18400340205.
- R. Adams and C. S. Marvel, Benzoine, Organic Syntheses, 1921, vol. 1, , p. 33. DOI:10.15227/orgsyn.001.0033. Coll. Vol. 1, 1941, p. 94 (PDF).
- Hardo Siegel, Manfred Eggersdorfer, Ketones, Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Wienheim 2002. DOI:10.1002/14356007.a15_077.
- Portail de la chimie