Hydrogénosulfate de sodium
L'hydrogénosulfate de sodium est un sel issu de la neutralisation partielle de l'acide sulfurique. Ce n'est pas un ampholyte mais un sel à caractère acide.
| Hydrogénosulfate de sodium | |
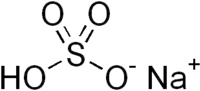
| |
| Identification | |
|---|---|
| Nom UICPA | hydrogénosulfate de sodium |
| Synonymes |
bisulfate de sodium |
| No CAS | |
| No ECHA | 100.028.787 |
| No CE | 231-665-7 |
| PubChem | 516919 |
| No E | E514(ii) |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | HNaO4S [Isomères] |
| Masse molaire[1] | 120,06 ± 0,006 g/mol H 0,84 %, Na 19,15 %, O 53,3 %, S 26,71 %, |
| Propriétés physiques | |
| T° fusion | 315 °C (décomposition) [2] |
| Solubilité | 1 080 g·l-1 (eau,20 °C) [2] |
| Masse volumique | 2,435 g·cm-3 à 13 °C [2] |
| Précautions | |
| Directive 67/548/EEC[2] | |
 Xi |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Il fait aussi partie des produits d'entretien communément employés dans les piscines, étant sans risque pour la santé humaine une fois dilué, et biodégradable.
Plus concentré, il peut être employé comme pesticide écologique notamment en milieu marin, permettant d'empoisonner un animal (le plus souvent par injection) sans risque pour l'environnement alentour. Il est notamment utilisé ainsi dans les campagnes de lutte contre l'étoile de mer invasive Acanthaster planci.
Il est utilisé dilué dans de l'eau en bijouterie pour le décapage et la désoxydation des métaux précieux, après soudure.
Il connait aussi un usage vétérinaire pour acidifier l'urine des chats et ainsi aider à prévenir la formation de calcul[3]

Réactions chimiques
L’équation de sa dissolution est :
NaHSO4(s) → Na+(aq) + HSO4−(aq)
L’ion HSO4− est un acide qui réagit avec H2O selon la réaction d’équation :
HSO4−(aq) + H2O(l) H3O+(aq) + SO42−(aq), pKa = 1,9
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Sodium hydrogensulfate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 9 novembre 2009 (JavaScript nécessaire)
- (en) Julie K. Spears, Christine M. Grieshop et G. C. Fahey, « Evaluation of sodium bisulphate and phosphoric acid as uine acidifiers for cats », Archives of Animal Nutrition, vol. 57, no 5, , p. 389–398 (ISSN 1745-039X et 1477-2817, DOI 10.1080/00039420310001607743, lire en ligne, consulté le )
- Portail de la chimie