Bromure de fer(II)
Le bromure de fer(II) est un composé inorganique de formule chimique FeBr2. Le composé anhydre est un solide paramagnétique de couleur jaune ou brunâtre. Plusieurs hydrates de FeBr2 sont également connus, tous étant des solides de couleur pâle. C'est un précurseur commun à d'autres composés du fer en laboratoire de recherche, mais aucune application n'existe pour ce composé.
| Bromure de fer(II) | |
| |
| Identification | |
|---|---|
| Nom UICPA | Bromure de fer(II) |
| No CAS | |
| No ECHA | 100.029.244 |
| PubChem | |
| Apparence | solide jaune-marron |
| Propriétés chimiques | |
| Formule | FeBr2 |
| Masse molaire[1] | 215,653 ± 0,004 g/mol Br 74,1 %, Fe 25,9 %, |
| Propriétés physiques | |
| T° fusion | 684 °C[réf. souhaitée] |
| T° ébullition | 934 °C[réf. souhaitée] |
| Solubilité | 117 g/100 ml d'eau[réf. souhaitée] |
| Masse volumique | 4,63 g cm−3, solide[réf. souhaitée] |
| Cristallographie | |
| Système cristallin | Rhomboédrique, hP3, SpaceGroup = P-3m1, no 164 |
| Composés apparentés | |
| Autres cations | Bromure de fer(III) |
| Autres anions | Chlorure de fer(II) |
| Unités du SI et CNTP, sauf indication contraire. | |
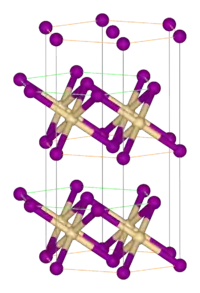
Structure
Comme la plupart des halogénures métalliques, FeBr2 adopte une structure polymérique composée de centres métalliques isolés réticulés avec des halogénures. Il cristallise avec la structure CdI2, comportant des couches serrées d'ions bromure, entre lesquelles se trouvent des ions Fe(II) dans des trous octaédriques[2]. L'emballage des halogénures est légèrement différent de celui du FeCl2, qui adopte le motif CdCl2.
Synthèse et réactions
Ce composé est synthétisé à l'aide d'une solution d'acide bromhydrique concentré et de poudre de fer dans du méthanol. On additionne du dihydrogène gazeux sur le complexe [Fe(MeOH)6]Br2. Le chauffage du complexe de méthanol sous vide donne du FeBr2 pur[3].
FeBr2 réagit avec deux équivalents de bromure de tétraéthylammonium pour donner [(C2H5)4N]2FeBr4[4]. FeBr2 réagit avec le bromure et le brome pour former les espèces à valence mixte de couleur intense [FeBr3Br9]−[5].
Magnétisme
FeBr2 possède un fort métamagnétisme à 4,2 K et a longtemps été étudié comme un composé métamagnétique prototypique[6],[7].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Iron(II) bromide » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- J. Haberecht, Η. Borrmann et R. Kniep, « Refinement of the crystal structure of iron dibromide, FeBr2 », Zeitschrift für Kristallographie - New Crystal Structures, vol. 216, nos 1–4, (DOI 10.1524/ncrs.2001.216.14.544)
- G. Winter, « Iron(II) Halides », Inorganic Syntheses, vol. 14, , p. 99–104 (ISBN 9780470132456, DOI 10.1002/9780470132456.ch20)
- N. S. Gill, F.
- Holleman, A. F. et Wiberg, E., Inorganic Chemistry, Academic Press, San Diego, 2001 (ISBN 0-12-352651-5)
- M. K. Wilkinson, J. W. Cable, E. O. Wollan et W. C. Koehler, « Neutron Diffraction Investigations of the Magnetic Ordering in FeBr2, CoBr2, FeCl2, and CoCl2 », Physical Review, vol. 113, no 2, , p. 497–507 (DOI 10.1103/PhysRev.113.497, Bibcode 1959PhRv..113..497W)
- I. S. Jacobs et P. E. Lawrence, « Metamagnetic Phase Transitions and Hysteresis in FeCl2 », Physical Review, vol. 164, no 2, , p. 866–878 (DOI 10.1103/PhysRev.164.866, Bibcode 1967PhRv..164..866J)
- Portail de la chimie