Cebus capucinus
Capucin, Sapajou capucin, Saï


LC : Préoccupation mineure
Statut CITES
Le sapajou capucin (Cebus capucinus) est un singe du Nouveau Monde de la famille des cébidés.
Nomenclature
Cebus capucinus est nommé par de nombreux noms vernaculaires : capucin moine[réf. nécessaire], sapajou capucin[1], sajou capucin[2],[1], saï[3],[4], capucin à face blanche[réf. nécessaire] ou plus simplement capucin[4].
Sous-espèces
L’espèce Cebus capucinus comprendrait quatre sous-espèces[5] :
Description morphologique
C’est la seule espèce de capucin dont la fourrure est noire sur le corps, les jambes et la queue. La coloration noire s’étend jusqu’à l’arrière de la tête en formant une calotte, certainement à l’origine de son nom vernaculaire « capucin moine ». Son pelage se distingue également par une coloration blanche de la tête, la gorge, les épaules et le haut des bras. Le visage est généralement rose et la quantité de fourrure blanche qui le recouvre est variable selon les classes d’âge et de sexe. La longueur corporelle d’un individu adulte se situe entre 33.5 à 45,3 cm et sa queue mesure entre 35.0 et 55,1 cm[8]. Le dimorphisme sexuel est peu prononcé. Les femelles pèsent en moyenne 2,67 kg alors que les mâles atteignent un poids moyen de 3,87 kg[9]. Le capucin moine se déplace sur ses quatre pattes et présente une bipédie occasionnelle[10]. Sa main est préhensile et son pouce pseudo opposable[11].
Traits d’histoire de vie
Longévité
Le record actuel de longévité en captivité pour un capucin est détenu par un capucin moine de presque 55 années[12]. Cependant, la durée de vie moyenne pour un capucin maintenu en captivité dans de bonnes conditions est de 44 ans[réf. nécessaire].
Les données de longévité sur les capucins vivant en milieu naturel sont rares ou inexistantes mais les auteurs s’accordent à affirmer (à l’instar de nombreuses espèces de vertébrés) que la durée de vie dans ces conditions est inférieure à celle observée en captivité[13].
Caractéristiques reproductives individuelles
Le statut reproducteur des femelles capucin moine n’est pas visible dans le sens où il n’existe pas de changement de couleur ou de morphologie au moment de l’œstrus. Les comportements proceptifs sont également rares chez cette espèce[14] ont cependant observé des échanges de regards et des inclinaisons de la tête réciproques ainsi que d’autres comportements tels que les « sniffing urine » ou encore les « duck face », les « pirouettes » et les « looking between legs » juste avant les montes. Les montes sexuelles sont peu révélatrices de la hiérarchie des mâles puisque dans cette espèce, tous les mâles semblent avoir accès aux femelles. Il n’y a pas de consort apparent bien que le mâle alpha soit le père de la majorité des jeunes. La gestation dure entre 157 et 167 jours[10]. Les femelles donnent naissance pour la première fois vers l’âge de 7 ans et l’intervalle moyen entre deux naissances est de 26,4 mois[15]. Les mâles deviennent potentiellement reproducteurs vers l’âge de 6 ans bien que de nombreux auteurs considèrent la maturité sexuelle à plus de 7 ans chez cette espèce. De plus Jack et Fedigan[16],[17] soulignent que 10 années peuvent être nécessaires pour que les mâles atteignent leur maturité physique. Il n’existe aucune donnée sur la sénescence de la fécondité des capucins.
Natalité
Il n’existe pas de saisonnalité des naissances chez le capucin moine mais, il existe cependant un pic de natalité pendant la saison sèche (Fedigan et al. 1996 ; Mitchell 1989 ; Oppenheimer 1968).
Socio-écologie du capucin moine
Habitat et distribution géographique
Le capucin moine occupe pratiquement tous les types de forêt néotropicale d'amérique . Il se trouve dans les forêts tropicales humides et sèches, les forêts inondées, les forêts de mangrove, les forêts-galeries, ainsi que dans les forêts sèches à feuilles caduques où les averses sont absentes 5 à 6 mois de l’année[10]. La répartition de Cebus capucinus est étagée du niveau de la mer jusqu’à 2 100 mètres d’altitude (Wolfheim 1983). Sa distribution géographique s’étend de l’extrême nord-ouest de l’Équateur jusqu’au Honduras, en passant par l’ouest de la Colombie, le Panama, le Costa Rica ainsi que le Nicaragua. Il existe également certaines populations sur l’île de Gorgona (Cebus capucinus curtus) située au large de la côte Pacifique de la Colombie et sur les îles de Coiba et de Jicaron (Cebus capucinus imitator) au large de Panama (Hernandez-Camacho & Cooper 1976 ; Marineros & Gallegos 1998 ; Reid 1997 ; Rodriguez-Luna et al. 1996).
Exploitation des domaines vitaux
Un groupe de capucins moines occupe un domaine vital d’1 km2 environ (Buckley 1983 ; Chapman 1987 ; Mitchell 1989 ; Oppenheimer 1968 ; Rose 1998). Rose (1998) a décrit que des groupes plus importants, avec un plus grand nombre de mâles adultes, occupent des territoires plus vastes que des groupes de plus petite taille. Oppenheimer (1968) qualifie les capucins moines de « territoriaux », en accord avec les observations de Buckley (1983) alors que Mitchell (1989) les considère comme étant plus xénophobiques que territoriaux dans le sens où ils interagissent de manière agressive quel que soit le lieu et le moment de la rencontre avec d’autres groupes plutôt que de défendre activement leur territoire. L’espèce Cebus capucinus occupe son domaine vital de manière relativement homogène. Les groupes se déplacent d’un site de nourriture (arbre) à un autre sans se focaliser sur un arbre particulier et ne restent jamais très longtemps au même endroit. Cependant, pendant la saison sèche, ils sont plus fréquemment observés fourrageant près des points d’eau qui deviennent un facteur déterminant l’occupation de leur domaine vital (Fedigan et al. 1996). Dès que les pluies reviennent, ils agrandissent très rapidement leur domaine vital et accroissent la longueur de leurs déplacements et.
Distribution spatiale des individus au niveau du groupe
La position d’un individu au sein de son groupe social peut influencer son succès de fourragement aussi bien que sa vulnérabilité aux prédateurs. La meilleure position pour le fourragement est l’avant du groupe alors que la position la plus sûre pour échapper à la prédation est le centre du groupe. Hall et Fedigan (1997) ont montré qu’en accord avec ces contraintes, les individus dominants se positionnent la plupart du temps à l’avant-centre du groupe, les enfants et les juvéniles sont plus au centre du groupe alors que les subordonnés se trouvent souvent à la périphérie du groupe. D’autre part, les individus semblent adapter leur dispersion en fonction de la taille et de la qualité du site exploité. Les capucins moines ont en effet tendance à fourrager seuls dans les petits arbres mais se répartissent en sous-groupes dans des arbres de taille moyenne et ne forment plus qu’un groupe dans des arbres de grande taille (Phillips 1995).
Cartes mentales et mémoire spatiale
Les capucins moines sont capables de cartographier mentalement l’emplacement de leurs sources de nourriture ainsi que le moment des disponibilités de ces ressources (King 1986). Garber et Paciulli (1997) ont mis en évidence qu’ils se servent plus de leur perception spatiale (carte mentale) que de la perception visuelle ou olfactive directe pour rechercher de la nourriture. Cependant, ils peuvent associer certains indices visuels à des ressources et semblent discriminer différentes quantités de nourriture. De plus, ils possèdent des capacités d’apprentissage rapides et très flexibles. Ces auteurs ont ainsi montré que le capucin moine, à l’instar d’autres espèces de primates et particulièrement des grands singes, utilisent majoritairement des informations spatiales globales dans le contexte de recherche alimentaire.
Utilisation du temps
Les capucins sont actifs tout au long de la journée. Au réveil, les mâles émettent de puissantes vocalisations appelées ‘gargles’ (Petit, Communication personnelle) ainsi que des cris de contact. Une fois tous les individus réveillés, le groupe commence à se déplacer à la recherche d’un arbre fruitier où ils prendront leur premier repas de la journée. Ils visitent ainsi un ou plusieurs arbres entre 5 heures et 9 heures du matin. Vers le milieu de la matinée, les capucins commencent à ralentir la cadence de leurs déplacements entre les arbres fruitiers pour commencer à rechercher les insectes. Jusqu’à la fin de la matinée, ils alternent ce fourragement avec de courtes périodes de repos et pendant la saison sèche, ils se rendent également à un point d’eau pour boire. Puis les jeunes passent un peu de temps à jouer alors que les adultes se toilettent. Le reste de la journée sera consacré de nouveau à la recherche de fruits et aux déplacements entre les différents sites. La nuit tombe assez tôt dans la forêt tropicale et le groupe commence souvent à se déplacer vers un site de repos pour la nuit entre 5 heures et 6 heures de l’après-midi. Les sites de sommeil les plus fréquemment choisis sont de grands arbres possédant de nombreuses branches horizontales et situés près d’un arbre fruitier. Les capucins moines passent la nuit à dormir en contact d’un ou deux congénères[13]. Globalement, ils occupent en moyenne 66 % de leur journée à s’alimenter, 10 % à se déplacer et le reste du temps est consacré aux activités sociales ou au repos (Freese 1978).
Régime alimentaire
Le capucin moine, par son régime alimentaire très opportuniste est considéré comme omnivore. Il se distingue en effet par la plus grande variabilité alimentaire des singes du Nouveau Monde (Rose 1994a). Cependant, il se nourrit principalement de fruits (65 %) et de feuilles (15 %). Le reste de son régime alimentaire est largement composé d’insectes ainsi que d’autres invertébrés tels que les araignées, les crabes ou encore les huîtres mais également de petits vertébrés (lézards, oiseaux, jeunes écureuils et coatis) ou encore d’œufs, de graines, noix, écorces, bourgeons, gommes et fleurs.
Flexibilité du régime alimentaire
Il existe cependant des différences de régime alimentaire entre les groupes : Chapman et Fedigan (1990) ont décrit des groupes voisins de C. capucinus qui se distinguent par leur alimentation majoritaire avec 83 % de fruits pour un groupe alors qu’un autre groupe était principalement faunivore avec 50 % de proies de type insectes ou vertébrés. Ces résultats suggèrent une origine culturelle de ces différences. Cependant, il existe également des différences au sein même des groupes (Rose 1994a, 1994b, 1998), principalement entre les mâles et les femelles, non pas au niveau de la ressource majoritaire qui reste le fruit mais dans le fait que les femelles fourragent plus que les mâles et les mâles consomment plus de proies animales que les femelles. Rose (1994a) suggère que la différence de taille entre les deux sexes – les mâles sont environ 30 % plus grands que les femelles – serait la meilleure explication de ces différences dans le régime alimentaire des deux sexes.
Manipulations dans le contexte alimentaire
Grâce à leur grande dextérité manuelle (Meunier & Vauclair, 2007) et à des techniques d’exploitation des ressources sophistiquées, ils accèdent à certains fruits et à certaines graines, que de nombreuses autres espèces ne parviennent pas à atteindre. Ils utilisent simultanément leurs mains et leurs dents pour tirer, mordre ou casser un item de nourriture potentiel. Les capucins frappent souvent des objets contenant de la nourriture, tels que les escargots, les noix ou d’autres fruits et graines bien protégés, contre un substrat rigide pour les casser et les ouvrir. Ce type de comportement est dit « combinatoire » puisqu’il requiert la combinaison de l’objet avec le substrat. Une fois l’objet ouvert, les capucins sont très agiles et présentent des gestes très contrôlés pour en extraire la nourriture. La manipulation et l’utilisation d’objet sont donc fréquentes chez cette espèce bien que le temps consacré à ces activités reste faible (< 1 %). Cependant l’utilisation d’outil en milieu naturel est très rarement décrite dans la littérature (Chevalier-Skolnikoff 1990 ; Garber & Brown 2004 ; Panger 1998 ; Tomblin & Cranford 1994).
Organisation et structure sociales
Taille et composition des groupes

Le capucin moine s’organise en groupes multimâles multifemelles. La taille moyenne d’un groupe est de 16 individus[18]. Ces groupes sont constitués en moyennes de 20 % de mâles adultes, 30 % de femelles adultes, 35 % de juvéniles et 15 % d’enfants. Le sexe ratio des adultes est donc de 0,7 en faveur des femelles. Toutes les classes d’âge et de sexe sont représentées au sein d’un groupe (Mitchell 1989 ; Rose 1994).
« Rôle » de chaque sexe
Les mâles défendent le territoire du groupe[10]. Ils sont les seuls ou principaux participants aux rencontres intergroupes (Perry 1996a). Quant aux femelles, elles sont philopatriques et forment le noyau du groupe en consacrant plus de temps aux activités sociales. Elles entretiennent ainsi des relations privilégiées entre elles (Fedigan 1993, Perry 1996b).
Relations de dominance

Les mâles présentent entre eux très peu de comportements de soumission, ce qui rend relativement difficile l’évaluation de leurs relations hiérarchiques. Cependant, selon Perry (1998), il semble que les mâles s’organisent selon une structure linéaire ou au moins que le mâle alpha domine individuellement tous les autres mâles ainsi que tous les autres membres du groupe (Fedigan 1993). Pour les femelles, la hiérarchie est linéaire. À l’échelle du groupe, les mâles dominent les femelles ou la femelle dominante peut dominer les autres mâles que le mâle alpha. Quant aux jeunes, ils sont le plus souvent dominés par les adultes mais il peut arriver que certains subadultes ou juvéniles dominent des femelles adultes subordonnées (Robinson & Janson 1987).
Patterns de dispersion
Chez les capucins, ce sont les mâles qui dispersent. Il existe deux patterns de dispersion chez Cebus capucinus : les mâles dispersent une première fois entre 3 et 6 ans. Cette première émigration, de leur groupe de naissance, ne semble corrélée ni avec la saison de reproduction, ni avec l’expulsion des mâles adultes résidents, ni avec l’arrivée éventuelle de mâles adultes étrangers au groupe, ayant récemment renversé les mâles adultes résidents[16]. Cette émigration natale serait principalement due à l’attraction de mâles extérieurs au groupe ou de partenaires de dispersion. Disperser à plusieurs permettrait en effet de diminuer la forte mortalité qui y est associée. Les mâles dispersent ensuite une seconde fois, également de manière volontaire[17]. Les apparentés semblent migrer ensemble. Étant plus âgés que lors de leur première dispersion, ils ont cette fois tendance à utiliser l’agression et la force pour intégrer un nouveau groupe. Les mâles qui dispersent tendent à obtenir une position élevée dans la hiérarchie et à augmenter leurs chances d’accéder aux femelles. Il a également été décrit que les mâles dispersent en moyenne tous les quatre ans alors que les femelles donnent naissance à leur premier enfant entre 6 et 7 ans, et ces faits suggèrent qu’en changeant de groupe plusieurs fois, les mâles diminuent le risque de se reproduire avec leurs filles.
Fission et fusion des groupes
Bien que la formation de nouveaux groupes soit rare, le phénomène de fission (qui se distingue de la dispersion d’un ou plusieurs mâles) a été observé. Ce sont généralement des groupes composés de 1 à 2 mâles ainsi que 1 à 3 femelles adultes accompagnées de leurs jeunes qui quittent leur groupe d’origine pour aller former leur propre groupe sur un territoire indépendant ou pour fusionner avec un autre petit groupe voisin (Oppenheimer 1968). Du fait que les femelles capucins quittent très rarement leur groupe d’origine et ne se déplacent jamais seules, les fissions restent rares et les nouveaux groupes sont presque exclusivement formés d’une matriline accompagnée d’un ou plusieurs mâles[13].
Répartition géographique
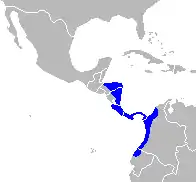
Cette espèce vit en Amérique centrale (Costa Rica, Honduras...) et au nord de l'Amérique du Sud.
Habitat
Ce singe fréquente notamment les forêts humides.
Synonymes
- C. albulus (Pusch, 1942)
- C. curtus (Bangs, 1905)
- C. hypoleucus (É. Geoffroy, 1812)
- C. imitator (Thomas, 1903)
- C. limitaneus (Hollister, 1914)
- C. nigripectus (Elliot, 1909)
Références
- (en) Murray Wrobel, 2007. Elsevier's dictionary of mammals: in Latin, English, German, French and Italian. Elsevier, 2007. (ISBN 0444518770), 9780444518774. 857 pages. Rechercher dans le document numérisé
- Nom vernaculaire français d'après Dictionary of Common (Vernacular) Names sur Nomen.at
- Nom vernaculaire en français d’après Termium plus, la banque de données terminologiques et linguistiques du gouvernement du Canada
- Voir définition donnée par le Grand dictionnaire terminologique de l’Office québécois de la langue française.
- Rylands, A. B., Schneider, H., Mittermeier, R. A., Groves, C. P. and Rodriguez-Luna, E. 2000. An assessment of the diversity of New World Primates. Neotropical Primates 8, 61-93.
- Groves, C. P. 2001. Primate Taxonomy. Washington, DC: Smithsonian Institution Press.
- Silva Jr., J. de S. 2001. Especiaçao nos macacaos-prego e caiararas, gênero Cebus Erxleben, 1777 (Primates, Cebidae). Doctoral thesis, Universidade Federal do Rio de Janeiro, Rio de Janeiro.
- (en) L. H. Emmons et F. Feer, Monkeys (Primates). Neotropical Rainforest Mammals: A Fiels Guide, University of Chicago Press, Chicago., , p. 134-153
- Ford, S. M. 1994. Evolution of sexual dimorphism in body weight in platyrrhines. American Journal of Primatology 34, 221-244.
- Freese, C. H. and Oppenheimer, J. R. 1981. The capuchin monkey, genus Cebus. In Coimbra-Filho A. F., Mttermeier R. A. (Eds), Ecology and Behavior of Neotropical Primates, vol 1, 331-390. Academia Brasileira de Ciências, Rio de Janeiro.
- Napier, J. R. and Napier, P. H. 1967. A handbook of the living primates: Morphology, ecology, and behaviour of nonhuman primates. J. R. Napier and P. H. Napier (Eds), pp. 87-93. Academic Press, London.
- Hakeem, A., Sandoval, R. G., Jones, M. and Allman, J. 1996. Brain and life span in primates. In Handbook of the Psychology of Aging (Fourth Edition), ed. J. E. Birren and K. W. Schaie, pp. 78-104. San Diego: Academic Press.
- Fragaszy, D. Visalberghi, E. and Fedigan, L. M. 2004. The Complete Capuchin. Cambridge University Press, Cambridge
- Manson, J. H., Perry, S. and Parish, A. R. 1997. Nonconceptive sexual behavior in bonobos and capuchins. International Journal of Primatology 18, 767-786.
- Fedigan, L.M. and Rose, L.M. 1995. Interbirth interval variation in three sympatric species of neotropical monkey. American Journal of Primatology 37, 9-24.
- (en) Katherine M. Jack et Linda Fedigan, Male dispersal patterns in white-faced capuchins, Cebus capucinus, patterns and causes of natal emigration, Animal Behaviour, (lire en ligne), partie 1, chap. 67, p. 761-769
- (en) Katherine M. Jack et Linda Fedigan, « Male dispersal patterns in white-faced capuchins, Cebus capucinus : Part 2, patterns and causes of secondary dispersal », Animal Behaviour, no 67, , p. 771-782 (lire en ligne)
- Fedigan, L.M. and Jack, K. 2001. Neotropical primates in a regenerating Costa Rican dry forest: a comparison of howler and capuchin population patterns. International Journal of Primatology 22, 689-713.
Bibliographie
- Buckley, J. S. 1983. The feeding behavior, social behavior, and ecology of the white-faced monkey, Cebus capucinus, at Trujillo, Northern Honduras. Doctoral Dissertation, University of Texas at Austin.
- Chapman, C. A. 1987. Foraging strategies, patch use, and constraints on group size in three species of Costa Rican primates. Doctoral Dissertation, University of Alberta.
- Chapman, C. A. and Fedigan, L. M. 1990. Dietary differences between neighboring Cebus capucinus groups: local traditions food availability or responses to food profitability? Folia Primatologica, 54 : 177-186.
- Chevalier-Skolnikoff, S. 1990. Tool use by wild Cebus monkeys at Santa Rosa National Park, Costa Rica. Primates, 31 : 375-383.
- Fedigan, L. M. 1993. Sex differences and intersexual relations in adult white-faced capuchins (Cebus capucinus). International Journal of Primatology, 14 : 853-877.
- Fedigan, L.M. and Rose, L.M. 1995. Interbirth interval variation in three sympatric species of neotropical monkey. American Journal of Primatology 37 : 9-24.
- Fedigan, L.M., Rose, L.M., Morera Avila, R. 1996 See how they grow: Tracking capuchin monkey (Cebus capucinus) populations in a regenerating Costa Rican dry forest. In: Adaptive radiations of neotropical primates. Ed. M.A. Norconk; AL Rosenberger; PA Garber. Plenum Press, NY p. 289-308.
- Freese, C. H. 1978. The behaviour of white-faced capuchins (Cebus capucinus) at a dry-season waterhole. Primates, 19 : 275-286.
- Garber, P. A. & Brown, E. 2004. Wild capuchins (Cebus capucinus) fail to use tools in an experimental field study. American Journal of Primatology, 62 : 165-170.
- Garber, P. A. & Paciulli, L. M. 1997. Experimental field study of spatial memory and learning in wild capuchin monkeys (Cebus capucinus). Folia Primatologica, 68 : 236-253.
- Hall, K. and Fedigan, L. M. 1997. Spatial benefits afforded by high rank in white-faced capuchins. Animal Behaviour, 53 : 1069-1082.
- Hernandez-Camacho, J. and Cooper, R. W. 1976. The nonhuman primates of Columbia. In Neotropical Primates. Field Studies and Conservation, ed. R.W. Thorington, Jr. and P. G. Heltne, p. 35-69.
- King, B. J. 1986. Extracting, foraging, and the evolution of primate intelligence. Human Evolution, 4 : 361-372.
- Marineros, L. and Gallegos, F. M. 1998. Guia de Campo de los Mamiferos de Honduras. Tegucigalpa, Honduras : Instituto National de Ambiente y Desarrollo (INADES).
- Meunier, H. & Vauclair, J. 2007. Hand preferences on unimanual and bimanual tasks in white-faced capuchins (Cebus capucins). American Journal of Primatology, 69 : 1064-1069.
- Mitchell, B. 1989. Resources, group behavior, and infant development in white-faced capuchin monkeys, Cebus capucinus. PhD thesis, University of California-Berkeley.
- Oppenheimer, J.G. 1968. Behaviour and Ecology of the White-Faced Monkey, Cebus capucinus, on Barro Colorado Island, C.Z.. Ph.D. dissertation, University of Illinois, Urbana.
- Panger, M. A. 1998. Object-use in free-ranging white-faced capuchins (Cebus capucinus) in Costa Rica. American Journal of Physical Anthropology, 106 : 311-321.
- Perry, S. 1996a. Intergroup encounters in wild white-faced capuchins, Cebus capucinus. International Journal of Primatology, 17(3): 309-330.
- Perry, S. 1996b. Female-female social relationships in wild white-faced capuchin monkeys, Cebus capucinus. American Journal of Primatology 40, 167-182.
- Perry, S. 1998. Male-male social relationships in wild white-faced capuchins, Cebus capucinus. Behaviour, 135 : 139-172.
- Phillips, K. 1995. Resource patch size and flexible foraging in white-faced capuchins (Cebus capucinus). International Journal of Primatology, 16 : 509-519.
- Reid, F. A. 1997. A Field Guide to the Mammals of Central America and Southeast Mexico. Oxford: Oxford University Press.
- Robinson, J. G. and Janson, C. H. 1987. Capuchins, squirrel monkeys, and atelines : socioecological convergence with Old World primates. In Primate Societies. B. B. Smuts, D. L. Cheney, R. M. Seyfarth, R. W. Wrangham and T. T. Struhsaker (Eds.), p. 69-82. Chicago: University of Chicago Press.
- Rodriguez-Luna, E., Cortes-Ortiz, L., Mittermeier, R. A. and Rylands, A. B. 1996. Ploan de accion para los primates Mesoamericanos. Unpublished report, IUCN/SSC Primate Specialist Group, Gland.
- Rose, L. M. 1994a. Sex differences in diet and foraging behavior in white-faced capuchins (Cebus capucinus). International Journal of Primatology, 15 : 95-114.
- Rose, L. M. 1994b. Benefits and costs of resident males to females in white-faced capuchins, Cebus capucinus. American Journal of Primatology, 32 : 235-248.
- Rose, L. 1998. Behavioral ecology of white-faced capuchins (Cebus capucinus) in Costa Rica. PhD. Thesis, Washington University, St. Louis, Mo.
- Tomblin, D. C. and Cranford, J. A. 1994. Ecological niche differences between Alouatta palliata and Cebus capucinus comparing feeding modes, branch use, and diet. Primates, 35 : 265-274.
- Wolfheim, J. H. 1983. Primates of the World : Distribution, Abundance, and Conservation. Univ of Washington Press, Seattle.
Voir aussi
Sources
- Extrait de la thèse d'Hélène Meunier, 2007. "Etude des mécanismes sous-jacents aux phénomènes collectifs chez un primate non humain (Cebus capucinus): de l'expérimentation à la modélisation". Université libre de Bruxelles et Université Louis Pasteur de Strasbourg.
Références externes
- (en) Référence Mammal Species of the World (3e éd., 2005) : Cebus capucinus
- (en) Référence CITES : espèce Cebus capucinus (Linnaeus, 1758) (+ répartition sur Species+) (consulté le )
- (fr) Référence CITES : taxon Cebus capucinus (sur le site du ministère français de l'Écologie) (consulté le )
- (fr+en) Référence ITIS : Cebus capucinus (Linnaeus, 1758)
- (en) Référence Animal Diversity Web : Cebus capucinus
- (en) Référence NCBI : Cebus capucinus (taxons inclus)
- (en) Référence UICN : espèce Cebus capucinus (Linnaeus, 1758) (consulté le )
Liens externes
- Portail des primates
- Portail de la Colombie
- Portail du Panama
- Portail du Costa Rica
- Portail du Nicaragua
- Portail du Honduras