Carbène
Le carbène est une molécule organique contenant un atome de carbone divalent.
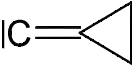
Des règles IUPAC précises permettent de les nommer[1].
Très stable dans un environnement tétravalent, le carbone peut également adopter un mode de liaison divalent. On lui attribue alors un doublet non liant et une lacune électronique.
Les carbènes sont en général utilisés comme intermédiaires réactionnels dans quelques réactions chimiques, où leur très forte instabilité permet de rendre réactives des fonctions relativement inertes. En particulier, ils peuvent réagir avec un alcène afin de générer un motif cyclopropane, ou s'insérer dans une liaison C-C ou C-H. Naturellement instables, les carbènes peuvent acquérir une certaine stabilité en s'associant à des métaux de transition pour former des complexes métallo-carbènes. La double liaison carbone-métal formée dans ce type de composés permet de stabiliser temporairement le carbène.
Des chercheurs ont récemment réussi à transformer à température presque ambiante (40 °C) du méthane en un ester (propionate d'éthyle) valorisable. Pour ce faire, un carbène (composé très réactif) a été introduit dans une liaison du méthane via un catalyseur organométallique[2].
La formation des carbènes est souvent effectuée à partir de composés diazo. La libération d'une molécule de diazote permet alors d'obtenir le carbone divalent.
Il existe des carbènes stables dits carbènes persistants comme ceux formés par des dérivés de l'imidazoline.
Les ligands carbènes
Comme dit précédemment, les carbènes sont généralement stabilisés à l'aide de métaux de transition (en). Il existe une classification précise de ceux-ci : les carbènes de Fisher et les carbènes de Schrock.
Notes et références
- (en) « Carbene », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- Brève d’Actualité Pour la science, n° 405, juillet 2011, page 7 (Brève non sourcée)