Grive à dos olive
Catharus ustulatus
_(4687323679).jpg.webp)
| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Aves |
| Ordre | Passeriformes |
| Famille | Turdidae |
| Genre | Catharus |

LC : Préoccupation mineure
La Grivette à dos olive (Catharus ustulatus), ou Grive de Swainson (d'après l'ornithologue anglais William Swainson), est une espèce de passereaux, de taille moyenne, appartenant à la famille des Turdidae.
Cet oiseaux est typique en termes de coloration, et doté d'un beau chant ascendant flûté.

Étymologie
Le nom de genre Catharus vient du grec ancien katharos, «pur ou propre» et se réfère au plumage de la grive C. aurantiirostris. Le nom d'espèce ustulatus signifie «brûlé» en latin (de urere, «brûler») évoque les taches sur le plumage[1].
Description
Taille : Cet oiseau mesure 16 à 20 cm (6,3 à 7,9 po) de longueur.
L'envergure moyenne des ailes est de 30 cm (12 po) et la bordure de l'aile est de 8,7–10,5 cm (3,4–4,1 po).
Le bec est long de 1,5 à 1,9 cm (0,59–0,75 po) ;
Le tarse mesure de 2,5 à 3,1 cm (0,98 à 1,22 po).
Poids : selon la saison et les individus, il varie de 23 à 45 g (0,81 à 1,59 oz)[2],[3].
Plumage : Le dessous des ailes présente un motif blanc-foncé-blanc caractéristique des grives Catharus. Les adultes sont bruns sur le dessus et blanc et brun sur les flancs, la poitrine est brun clair avec des taches plus foncées. Les pattes sont roses et l’œil est cerclé d'un trait brun clair. Les oiseaux de l'Est sont plus brun olive sur les parties supérieures ; les oiseaux occidentaux sont plus brun rougeâtre.
chant : c'est une série hâtive de tons flûtés qui s'élèvent vers les aiguës en spirale.
Sous-espèces et génétique des populations
Selon Alan P. Peterson, cette espèce est constituée de six sous-espèces :
- Catharus ustulatus appalachiensis Ramos 1991
- Catharus ustulatus incanus (Godfrey) 1952
- Catharus ustulatus oedicus (Oberholser) 1899
- Catharus ustulatus phillipsi Ramos 1991
- Catharus ustulatus swainsoni (Tschudi) 1845
- Catharus ustulatus ustulatus (Nuttall) 1840
D'autres auteurs reconnaissent quatre sous-espèces
- Catharus ustulatus alame
- Catharus ustulatus swainsoni
- Catharus ustulatus ustulatus
- Catharus ustulatus oedicus
Les deux premières (alame et swainsoni) passent l'été à l'est des montagnes de la côte de la Colombie-Britannique, des Cascades et de la Sierra Nevada, alors que les sous-espèces ustulatus et oedicus passent l'été à l'ouest de ces chaînes... avec une petite zone de chevauchement dans les montagnes côtières.
Des travaux récents de systématique basés sur la génétique moléculaire[4] confirment que ces deux paires de sous-espèces forment deux clades génétiquement distincts, dits clades continental et côtier. Ces clades ont récemment divergé (au cours de la fin du Pléistocène, il y a probablement environ 10 000 ans, alors que les habitats des grives se déplaçaient à travers l'Amérique du Nord[4]
Les routes migratoires actuelles des oiseaux continentaux, en particulier les populations occidentales, ne sont pas optimales en termes écologiques ; elles représentent vraisemblablement un modèle de route historique récemment hérité, et qui ne s'est pas encore adapté aux migrations des populations modernes de ces oiseaux[4]. Les différences génétiques entre les sous-espèces, et ce grand détour migratoire effectué par les populations continentales suggèrent fortement que ces espèces ont subi une expansion rapide de leur aire de répartition après la fin de la dernière période glaciaire, avec des populations qui estivaient à l'origine dans le sud-est de l'Amérique du Nord, étendant leur aire vers le nord et l'ouest au fur et à mesure que la glace libérait de l'espace et que la mer remontait[4].
Les détails récemment apportés par la génétique moléculaire soutiennent également l'hypothèse d'une expansion rapide des populations côtières et continentales. Cependant l'analyse de l'ADNmt du cytochrome b et de la sous-unité 2 de la NADH déshydrogénase, ainsi que les données de séquence d'intron 7 du β-fibrinogène nucléaire[5] montrent que la Grive à dos olive est la plus ancienne espèce nord-américaine de son genre ; elle n'est pas étroitement liée aux autres espèces du genre Catharus ; les similitudes extérieures avec les autres espèces nord-américaines ne seraient dues qu'à une évolution convergente.
Habitats, Répartition
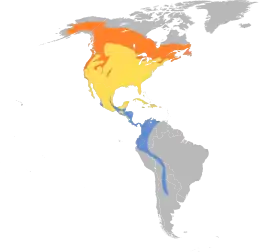
- aire de nidification
- voie migratoire
- zone d'hivernage
Dans son « aire de reproduction » (en orange sur la carte ci-contre), la grive à dos olive choisit généralement des forêts ou boisements de conifères à forte naturalité, et au sous-bois dense, au Canada, en Alaska et au nord des États-Unis. Des populations se reproduisent toutefois aussi en forêts ou bois feuillus, sur la côte pacifique de l'Amérique du Nord.
Après la période de reproduction et l'élevage des petits, les populations migrent vers le sud du Mexique et pour certaines aussi loin qu'au sud que l'Argentine.
Les sous-espèces côtières migrent le long de la côte pacifique de l'Amérique du Nord et hivernent du Mexique au Costa Rica, tandis que les oiseaux continentaux migrent vers l'est de l'Amérique du Nord (en faisant un détour important) pour ensuite s'éloigner vers le sud via la Floride et hiverner du Panama à la Bolivie.
Exceptionnellement des individus vagabonds sont observés en Europe occidentale, et même jusqu'en Asie du nord-est[6].
Reproduction
Le nid est généralement construit sur une branche d'arbre horizontale.
Alimentation
Cette grive se nourrit sur les sols forestiers, ainsi que dans les arbres[7].
Elle mange principalement des insectes, des fruits et des baies. Et parmi la large gamme de fruits consommés par cet oiseau, ceux de Cymbopetalum mayanum (Annonaceae) et surtout Trophis racemosa (Moraceae ) sont appréciés chaque fois qu'ils sont disponibles dans les quartiers d'hiver. Cependant, ils ne sont généralement pas prélevés dans les mangeoires ou dans un habitat perturbé notait Foster en 2007[8].
Etat des populations, menaces
Comme de nombreux oiseaux, cette espèce souffre de l'artificialisation et de la fragmentation forestière et parfois de la destruction et/ou pollution de ses habitats.
Elle pourrait en outre être repoussée par la Grive ermite là où leurs aires de répartition se chevauchent, car il semble que cette dernière espèce s'adapte plus facilement à l'anthropisation de ses habitats. Au moins dans les quartiers d'hiver, la grive à dos olive tend en effet à se tenir à l'écart des zones construites et des activités humaines.
Grive à dos olive et COVID 19 ?
En 2020, alors que la pandémie de COVID-19, causée par un nouveau coronavirus (SRAS-CoV-2) se propageait très rapidement sur toute la planète, et alors qu'on ne connaissait toujours pas l'espèce réservoir (ou les espèces-réservoirs) du virus, des scientifiques ont recherché quels étaient les animaux sauvages, domestiques ou proches de l'Homme susceptibles d'être infectés par les variants dominants du virus[9]. Une analyse comparative a été faite entre les souches de coronavirus (SARS-CoV-2 et non-SARS-CoV-2) afin d'élucider leurs relations phylogénétiques. Ce travail, entre autres choses, s'est notamment intéressé aux séquences génétiques codant le récepteur du virus (l'ACE2) chez 29 hôtes très différents (dont l'être humain)[9]. Ils constatent qu'on pourrait les classer en 3 clades. Les séquences du gène ACE2 les plus proches de celles des humains trouvés dans les bases de données comprennent (par ordre décroissant de proximité) celles de Nannospalax galili (rat-taupe aveugle des montagnes de Haute-Galilée), Phyllostomus discolor (chauve-souris à nez pâle), Mus musculus (souris domestique), Delphinapterus leucas (béluga) et ...Catharus ustulatus (la grive à dos olive)[9]. Ceci est intrigant car jusqu'alors les oiseaux testés et notamment les volailles ne semblaient pas vulnérables au virus faute d'ACE2 permettant au virus de se fixer sur les cellules pour les infecter[9].
Les auteurs ont conclu de leur étude que le SRAS-CoV-2 pourrait avoir évolué à partir d'un ancêtre commun éloigné des coronavirus aujourd'hui communs, mais pas à partir d'une branche de l'un des coronavirus aujourd'hui communs, ce qui implique que le SARS-CoV-2 agent de la COVID-19 pandémique pourrait avoir existé chez un hôte animal qui pourrait ne pas être identifié avant longtemps[9].
Des outils bioinformatiques, associés à des outils de gestion des connaissances, sont utilisés sur le SRAS-CoV-2 pour détecter le motif de sous-séquence (macro-domaine) d'intérêt particulier, car très hautement conservé dans le SRAS-CoV-2 et au-delà des coronavirus. retrouvé dans les protéines humaines et qui pourrait donc être une cible médicamenteuse. Dans ce travail, la grive à dos olive est l'une des quelques espèces d'oiseaux qui ont attiré l'attention des chercheurs[10].
Liens externes
- (fr) Référence Oiseaux.net : Catharus ustulatus (+ répartition)
- (en) Référence Congrès ornithologique international : (consulté le )
- (en) Référence Zoonomen Nomenclature Resource (Alan P. Peterson) : Catharus ustulatus dans Passeriformes
- (fr+en) Référence Avibase : Catharus ustulatus (Nuttall, 1840) (+ répartition) (consulté le )
- (fr) Référence CITES : taxon Catharus ustulatus (sur le site du ministère français de l'Écologie) (consulté le )
- (en) Référence Fauna Europaea : Catharus ustulatus
- (fr+en) Référence ITIS : Catharus ustulatus (Nuttall, 1840)
- (en) Référence Animal Diversity Web : Catharus ustulatus
- (en) Référence NCBI : Catharus ustulatus (taxons inclus)
- (en) Référence UICN : espèce Catharus ustulatus (Nuttall, 1840) (consulté le )
Notes et références
- James A. Jobling, The Helm dictionary of scientific bird names [electronic resource] : from aalge to zusii, Londres, Christopher Helm, (ISBN 978-1-4081-3326-2, lire en ligne)
- (en) « Swainson's Thrush Life History, All About Birds, Cornell Lab of Ornithology », sur www.allaboutbirds.org (consulté le )
- Peter Clement, Thrushes, Princeton University Press, (ISBN 0-691-08852-7, lire en ligne)
- (en) Kristen C. Ruegg et Thomas B. Smith, « Not as the crow flies: a historical explanation for circuitous migration in Swainson's thrush ( Catharus ustulatus ) », Proceedings of the Royal Society of London. Series B: Biological Sciences, vol. 269, no 1498, , p. 1375–1381 (ISSN 0962-8452 et 1471-2954, PMID 12079661, PMCID PMC1691041, DOI 10.1098/rspb.2002.2032, lire en ligne, consulté le )
- (en) Kevin Winker et Christin L. Pruett, « Seasonal Migration, Speciation, and Morphological Convergence in the Genus Catharus (Turdidae) », The Auk, vol. 123, no 4, , p. 1052–1068 (ISSN 1938-4254 et 0004-8038, DOI 10.1093/auk/123.4.1052, lire en ligne, consulté le )
- Mark Brazil et David Nurney, Field guide to the birds of East Asia : Eastern China, Taiwan, Korea, Japan and Eastern Russia, Christopher Helm, (ISBN 978-1-4081-3873-1, lire en ligne)
- S. Wiley, R. Kannan, D. James et A. Deshwal, « Foraging Behavior of Swainson's Thrushes (Catharus ustulatus) During Spring Migration through Arkansas », Journal of the Arkansas Academy of Science, vol. 69, no 1, , p. 124–129 (ISSN 2326-0491, lire en ligne, consulté le )
- (en) Mercedes S. Foster, « The potential of fruit trees to enhance converted habitats for migrating birds in southern Mexico », Bird Conservation International, vol. 17, no 1, , p. 45–61 (ISSN 1474-0001 et 0959-2709, DOI 10.1017/S0959270906000554, lire en ligne, consulté le )
- Fei-Feng Li, Qiong Zhang, Gui-Yu Wang &Shu-Lin Liu (2020) Comparative analysis of SARS-CoV-2 and its receptor ACE2 with evolutionarily related coronaviruses (Lettre à l'éditeur, signée le 17 juin 2020 et publiée le 7 novembre 2020), AGING 2020, Vol. 12, n°21 | cc-by-sa 3.0
- (en) « The use of knowledge management tools in viroinformatics. Example study of a highly conserved sequence motif in Nsp3 of SARS-CoV-2 as a therapeutic target (voir Tableau 3. Summary of VVVNAAN domain core BLASTp matches on the vertebrates only.) », Computers in Biology and Medicine, vol. 125, , p. 103963 (ISSN 0010-4825, PMID 32828990, PMCID PMC7424310, DOI 10.1016/j.compbiomed.2020.103963, lire en ligne, consulté le )
- Portail de l'ornithologie
- Portail de l’Amérique du Nord