Champignon filamenteux
La notion de champignon filamenteux (Mold ou Filamentous Fungi pour les anglophones) est une catégorisation morphologique et non taxonomique. Cette dénomination est notamment utilisée dans le monde médical.
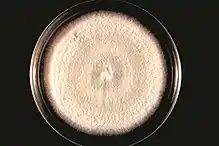
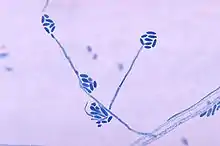
Elle désigne de manière générale tout champignon (parasite et/ou saprophyte) qui présente un aspect cotonneux lors de sa croissance (ces filaments ou hyphes, étant composés de matière organique). Chez les anglophones Mold peut aussi désigner le dépôt filamenteux laissé par le champignon mort[1].
On en trouve dans tous les milieux, jusque autour des sources hydrothermales des grands fonds marins avec des espèces dites extrêmophiles[2]
Éléments de caractérisation
Ces champignons n'existent souvent dans la nature qu'à l'état de colonies et non à l'état de cellules uniques indépendantes[3] (ce qui les différencie des levures).
Il s'agit le plus souvent de moisissures, mais certains auteurs classent les Pezizomycetes (autrefois appelés discomycètes) parmi les champignons filamenteux (car formés d'hyphes). Selon le Medical Dictionary Farlex Partner (version 2012) il s'agit de champignons filamenteux, prenant généralement la forme d'une colonie circulaire pouvant présenter un aspect cotonneux, laineux, ou glabres, mais toujours caractérisés par des filaments qui ne sont pas organisés en grands organes de fructification, comme ils le seraient chez les champignons "vrais".
Leurs hyphes sont caractérisées par une forte polarisation[4] qui permet leur croissance plus ou moins arborescentes et filamenteuse[5],[6],[7].
Contrairement à ce qu'on a longtemps pensé, certaines espèces semblent pouvoir dans certaines conditions former des biofilms (comme le font certaines algues, bactéries[8] et levures[9]), ce qui pourrait renforcer leur efficacité pathogène et défenses face à des molécules fongicides[3],[10].
Pathogénicité
Certains de ces champignons peuvent attaquer divers tissus humains, c'est par exemple le cas des Aspergillus[11] et Dermatophytes[12].
Usages industriels
Ces champignons capables de synthétiser des acides organiques et des molécules complexes[13],[14] intéressent l'industrie des biotechnologies et de la pharmacie ; ce sont des cultures de champignons filamenteux qui permettent par exemple de produire massivement l'acide citrique et la pénicilline. Leur culture contrôlée en milieu submergé est plus délicat que pour les levures, mais on cherche à rendre de telles cultures possibles[15].
Notes et références
- Miller-Keane (2003) Encyclopedia and Dictionary of Medicine, Nursing, and Allied Health, 7e édition, Saunders, Ed : Elsevier, Inc.
- Burgaud, G., Le Calvez, T., Arzur, D., Vandenkoornhuyse, P., & Barbier, G. (2009). Diversity of culturable marine filamentous fungi from deep‐sea hydrothermal vents. Environmental Microbiology, 11(6), 1588-1600.
- Harding, M. W., Marques, L. L., Howard, R. J., & Olson, M. E. (2009). Can filamentous fungi form biofilms ?. Trends in microbiology, 17(11), 475-480.
- Harris, S. D. (2006). Cell polarity in filamentous fung i: shaping the mold. International review of cytology, 251, 41-77 (résumé).
- Steven D Harris, Michelle Momany (2004), Polarity in filamentous fungi: moving beyond the yeast paradigm ; Fungal Genetics and Biology, Volume 41, Issue 4, avril 2004, pp391–400
- Michelle Momany (2002), Polarity in filamentous fungi: establishment, maintenance and new axes ; Current Opinion in Microbiology, Vol 5, Issue 6, 1er décembre 2002, Pages 580–585
- Aleksandra Virag, Steven D. Harris (2006), The Spitzenkörper: a molecular perspective ; Mycological Research, Vol 110, Issue 1, janvier 2006, Pages 4–13
- Hall-Stoodley L. & al. (2004) Bacterial biofilms: from the natural environment to infectious diseases. Nat. Rev. Microbiol. 2, 95 – 108
- Seneviratne C.J. & al. (2008) Biofilm lifestyle of Candida: a mini review. Oral Dis. 14, 482 – 590
- Blankenship, J.R & Mitchell A.P. (2006) How to build a biofilm: a fungal perspective. Curr. Opin. Microbiol. 9, 588 – 594
- St-Germain G & Summerbell R (1996) Identifying filamentous fungi: a clinical laboratory handbook. Star Publishing Company.
- « Annales de dermatologie et de vénéréologie (2012) », Annales de dermatologie et de vénéréologie, (Oui)
- Jeenes D.J, Mackenzie D.A, Roberts I.N & Archer D.B.(1991) 9 Heterologous Protein Production by Filamentous Fungi. Biotechnology and genetic engineering reviews, 9(1), 327-367.
- Magnuson J.K & Lasure L.L (2004). Organic acid production by filamentous fungi. In Advances in fungal biotechnology for industry, agriculture, and medicine (pp. 307-340). Springer US.
- Gibbs P.A, Seviour R.J & Schmid F (2000) Growth of filamentous fungi in submerged culture: problems and possible solutions. Critical reviews in biotechnology, 20(1), 17-48 (résumé).
Voir aussi
Articles connexes
Bibliographie
- Covert, S. F. (1998). Supernumerary chromosomes in filamentous fungi. Current genetics, 33(5), 311-319 (résumé).
- Frisvad, J. C., Andersen, B., & Thrane, U. (2008). The use of secondary metabolite profiling in chemotaxonomy of filamentous fungi. Mycological research, 112(2), 231-240.
- Grimm, L. H., Kelly, S., Krull, R., & Hempel, D. C. (2005). Morphology and productivity of filamentous fungi. Applied microbiology and biotechnology, 69(4), 375-384 (résumé).
- Keller, N. P., & Hohn, T. M. (1997). Metabolic pathway gene clusters in filamentous fungi. Fungal Genetics and Biology, 21(1), 17-29.
- Kistler, H. C., & Miao, V. P. (1992). http://www.annualreviews.org/doi/pdf/10.1146/annurev.py.30.090192.001023 New modes of genetic change in filamentous fungi]. Annual review of phytopathology, 30(1), 131-153.
- Leslie, J. F., & Klein, K. K. (1996). Female fertility and mating type effects on effective population size and evolution in filamentous fungi. Genetics, 144(2), 557-567.
- Magnuson, J. K., & Lasure, L. L. (2004). Organic acid production by filamentous fungi. In Advances in fungal biotechnology for industry, agriculture, and medicine (pp. 307-340). Springer US.
- Meletiadis, J., Meis, J. F., Mouton, J. W., & Verweij, P. E. (2001). Analysis of growth characteristics of filamentous fungi in different nutrient media. Journal of clinical microbiology, 39(2), 478-484.
- Möller, E. M., Bahnweg, G., Sandermann, H., & Geiger, H. H. (1992). A simple and efficient protocol for isolation of high molecular weight DNA from filamentous fungi, fruit bodies, and infected plant tissues. Nucleic Acids Research, 20(22), 6115.
- Pringle, A., & Taylor, J. W. (2002). The fitness of filamentous fungi. Trends in microbiology, 10(10), 474-481.
- Roca, M. G., Read, N. D., & Wheals, A. E. (2005). Conidial anastomosis tubes in filamentous fungi. FEMS microbiology letters, 249(2), 191-198.
- Soanes, D. M., Alam, I., Cornell, M., Wong, H. M., Hedeler, C., Paton, N. W., ... & Talbot, N. J. (2008). Comparative genome analysis of filamentous fungi reveals gene family expansions associated with fungal pathogenesis. PLoS One, 3(6), e2300.
- Unkles S.E (1992) Gene organization in industrial filamentous fungi. In Applied molecular genetics of filamentous fungi (pp. 28-53). Blackie Academic and Professional Glasgow (résumé).
- Portail de la mycologie