Chlorure de dichloroacétyle
Le chlorure de dichloroacétyle est un composé organique de formule chimique CHCl2COCl. Il se présente sous la forme d'un liquide incolore à jaunâtre à l'odeur piquante qui dégage des fumées lorsqu'il est exposé à l'air libre. Il s'agit du chlorure d'acyle de l'acide dichloroacétique CHCl2COOH, et redonne cet acide par hydrolyse. Il est utilisé dans les réactions d'acylation[3]. C'est également un précurseur de certains antibiotiques, dont le chloramphénicol.
| Chlorure de dichloroacétyle | |
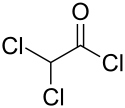
| |
| Structure du chlorure de dichloroacétyle | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.001.091 |
| No CE | 201-199-9 |
| No RTECS | AO6650000 |
| PubChem | 6593 |
| ChEBI | 34688 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore à jaunâtre à l'odeur piquante, fumant au contact de l'air |
| Propriétés chimiques | |
| Formule | C2HCl3O [Isomères] |
| Masse molaire[1] | 147,388 ± 0,008 g/mol C 16,3 %, H 0,68 %, Cl 72,16 %, O 10,86 %, |
| Propriétés physiques | |
| T° ébullition | 107 °C[2] |
| Solubilité | s'hydrolyse rapidement au contact de l'eau |
| Masse volumique | 1,53 g·cm-3[2] à 20 °C |
| T° d'auto-inflammation | > 600 °C[2] |
| Limites d’explosivité dans l’air | 11,9 % vol. |
| Pression de vapeur saturante | 3,06 kPa[2] à 20 °C |
| Précautions | |
| SGH[2] | |
  Danger |
|
| Transport[2] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Contrairement à la plupart des chlorures d'acides, on ne l'obtient pas à partir de l'acide carboxylique correspondant, mais plutôt par oxydation du 1,1,2-trichloroéthane CHCl2CH2Cl, par hydrolyse du pentachloroéthane CCl3CHCl2, et par carboxylation du chloroforme CHCl3 en présence de chlorure d'aluminium AlCl3[4] :
- CHCl2CH2Cl + O2 → CHCl2COCl + H2O,
- CHCl2CCl3 + H2O → CHCl2COCl + 2 HCl,
- CHCl3 + CO2 → CHCl2COCl + 1⁄2 O2.
On peut également l'obtenir en faisant réagir de l'acide dichloroacétique CHCl2COOH avec du chlorure de thionyle Cl2SO.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Dichloroacetyl chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 19 juillet 2017 (JavaScript nécessaire)
- (en) Richard P. Pohanish et Stanley A. Greene, Wiley Guide to Chemical Incompatibilities, John Wiley & Sons, 25 August 2009, pp. 327–328, (ISBN 978-0-470-52330-8).
- (en) G. Koenig, E. Lohmar, N. Rupprich, (2005), « Chloroacetic Acids », Ullmann's Encyclopedia of Industrial Chemistry, Weinheim: Wiley-VCH, 2005, DOI:10.1002/14356007.a06_537.
- Portail de la chimie
