Chlorure de strontium
Le chlorure de strontium (SrCl2) est un sel de strontium et du chlorure. C'est un sel classique, formant une solution aqueuse neutre. Comme tous les composés de strontium, lors de sa combustion ce sel émet une flamme de couleur rouge vif, et donc utilisée pour les feux d'artifice pour obtenir cette couleur. Ses propriétés chimiques sont intermédiaires entre celles du chlorure de baryum, qui est plus toxique, et le chlorure de calcium.
| Chlorure de strontium | |

| |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.030.870 |
| No CE | 233-971-6 |
| Code ATC | V10 |
| SMILES | |
| InChI | |
| Apparence | cristaux blancs cubiques hygroscopiques |
| Propriétés chimiques | |
| Formule | SrCl2 |
| Masse molaire[1] | 158,53 ± 0,01 g/mol Cl 44,73 %, Sr 55,27 %, |
| Propriétés physiques | |
| T° fusion | 874 °C |
| T° ébullition | 1 250 °C |
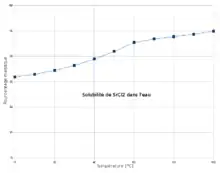
| Solubilité | 54.7 g/100g eau à 25 °C |
| Masse volumique | 3,052 |
| Cristallographie | |
| Symbole de Pearson | [2] |
| Classe cristalline ou groupe d’espace | Fm3m (n°225) [2] |
| Strukturbericht | C1[2] |
| Structure type | CaF2 [2] |
| Précautions | |
| SIMDUT[3] | |
Produit non contrôlé |
|
| Directive 67/548/EEC | |
 Xi |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Préparation
Le chlorure de strontium peut être préparé en traitant l'hydroxyde de strontium ou de carbonate de strontium avec de l'acide chlorhydrique.
- Sr(OH)2 + 2 HCl → SrCl2 + 2 H2O
ou
- SrCO3 + 2 HCl → SrCl2 + H2O + CO2
La cristallisation dans une solution aqueuse froide donne l'hexahydrate, SrCl2·6H2O. La déshydratation de ce sel se fait par étapes, en commençant au-dessus de 61 °C et la déshydratation complète survient à 320 °C[4].
Structure
Le solide adopte une structure rutile déformée. Dans sa phase gazeuse, la molécule SrCl2 est non-linéaire avec un angle Cl-Sr-Cl de 130° environ. Ceci est une exception à la théorie VSEPR qui prédit une structure linéaire. Des calculs ab initio ont été cités pour proposer que les contributions des orbitales d au-dessous de la couche de valence sont responsables[5]. Une autre proposition est que la polarisation du noyau d'électrons de l'atome de strontium provoque une distorsion de la densité électronique de base qui interagit avec les liens Sr-Cl[6].
Utilisation
Le chlorure de strontium est le précurseur d'autres composés de strontium, tels que le chromate de strontium jaune, qui est utilisé comme un inhibiteur de corrosion pour l'aluminium. Les processus de précipitations sont analogues à ceux des sulfates de isostructuraux[4] :
- SrCl2 + Na2CrO4 → SrCrO4 + 2 NaCl
Le chlorure de strontium est souvent utilisé comme colorant rouge dans la pyrotechnie. Il est employé en petites quantités dans la fabrication du verre et la métallurgie.
L'isotope radioactif du strontium 89, utilisé pour le traitement des douleurs métastatiques des os par radiothérapie métabolique, est habituellement administré sous forme de chlorure de strontium[7],[8]. Les aquariums d'eau de mer nécessitent de petites quantités de chlorure de strontium, qui est consommé dans la production de l'exosquelette de certains planctons.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Strontium chloride » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « The Fluorite (C1) Structure », sur http://cst-www.nrl.navy.mil/ (consulté le )
- « Chlorure de strontium » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009
- J. Paul MacMillan, Jai Won Park, Rolf Gerstenberg, Heinz Wagner, Karl Köhler, Peter Wallbrecht "Strontium and Strontium Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, 2005, Wiley-VCH: Weinheim. DOI 10.1002/14356007.a25 321
- (en) Seijo L.,Barandiarán Z « Ab initio model potential study of the equilibrium geometry of alkaline earth dihalides: MX2 (M=Mg, Ca, Sr, Ba; X=F, Cl, Br, I) » J. Chem. Phys. 1991;94:3762. DOI:10.1063/1.459748
- (en) Guido M. et Gigli G. « Ion model and equilibrium configuration of the gaseous alkaline-earth dihalides » J. Chem. Phys. 1976;65:1397. DOI:10.1063/1.433247
- (en) Steven Baumrucker, « Palliation of painful bone metastases: Strontium-89 », Am J Hosp Palliat Care, vol. 15, no 2, , p. 113-5. (PMID 9543899, DOI 10.1177/104990919801500210, résumé)
- (en) Bauman G, Charette M, Reid R, Sathya J, « Radiopharmaceuticals for the palliation of painful bone metastasis-a systemic review », Radiother Oncol, vol. 75, no 3, , p. 258-70. (PMID 16299924, DOI 10.1016/j.radonc.2005.03.003, résumé)
- Portail de la chimie
- Portail de la pharmacie