Cicatrisation
La cicatrisation se présente sous deux aspects :
- un phénomène de régénération : on parle alors du processus par lequel se réparent les lésions des tissus et des organes (plaie, brûlures, etc.) ;
- un phénomène de consolidation ou de réconciliation d'éléments auparavant unis et qui avaient été séparés.



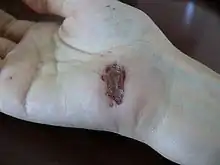


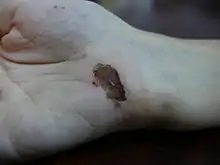
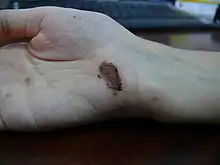





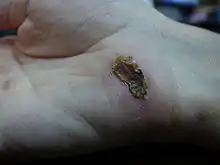





On distingue la cicatrisation "de première intention", qui se produit spontanément et rapidement quand les bords de la plaie sont rapprochés ; et la cicatrisation "de seconde intention", dans le cas contraire, qui nécessite un traitement dermatologique (pommade, solution...) ou physique (bistouri, curette...).
Étapes (cas d'une plaie de la peau)
Cicatrisation des couches superficielles (atteinte de l'épiderme)
Une lésion cutanée est une destruction cellulaire. La cicatrisation se déroule de la manière suivante : en se nécrosant, les cellules libèrent un facteur de croissance épidermique ; sous l'action d'une hormone protéique, les cellules saines de la couche basale épidermique (Stratum germinativum) se divisent et migrent vers la lésion. La migration s'arrête quand la lésion est comblée par de nouvelles cellules. Ces nouvelles cellules se redivisent et reconstituent les différentes couches de l'épiderme.
- Durée : 24 à 48 heures.
- Exemples : coupure, écorchure…
Cicatrisation des couches profondes (atteinte du derme)
Il y a 4 stades, outre la phase inflammatoire.
Phase inflammatoire
Cette phase consiste à éliminer les corps étrangers et les tissus morts en quelques jours. Pendant cette phase, la lésion est recouverte par un caillot sanguin. La réaction inflammatoire provoque une vasodilatation et augmente la perméabilité des vaisseaux sanguins au niveau de la lésion. Il existe également une stimulation du système immunitaire par le biais de l'augmentation de l'expression du récepteur de l'EGF[1].
Angiogenèse
Il y a formation de nouveaux vaisseaux sanguins, à partir des vaisseaux préexistants par bourgeonnement. L'angiogenèse permet l'apport en nutriments et oxygène, indispensables aux cellules.
Phase de migration
Le caillot sanguin devient une croûte à cause de la prolifération des filaments de fibrine. La croûte est un tissu de renouvellement et donc de granulation, c'est le début de l'élaboration de la cicatrice. Sous la croûte, toutes les cellules de tissu conjonctif migrent vers le centre de la lésion. Les vaisseaux vont proliférer et se refaire.
Phase de prolifération
C'est la prolifération massive de cellules, de vaisseaux sanguins et de fibres. Les fibroblastes migrent suivant le réseau de fibrine. Il existe une ré-épithélisation à partir des berges de la plaie[2].
Phase de maturation
La maturation est la phase la plus longue. Elle se poursuit pendant plus d'un an. Au début, la croûte tombe et la peau va retrouver ses différentes couches. Le nombre de fibroblastes va diminuer ainsi que le nombre de vaisseaux sanguins. La peau va rester plus ou moins blanche car le taux de mélanocytes se reconstituera plus tard.
Normalement après 6 mois, une cicatrice doit être souple et indolore. Cependant, des troubles de la cicatrisation peuvent engendrer des cicatrices dysharmonieuses.
Anomalies
La cicatrisation peut être gênée par la taille de la plaie, la présence d'un corps étranger, d'une infection, d'une ischémie chronique, une altération de la réponse au stress (personnes âgées, par exemple, du fait d'une dénutrition ou d'une maladie générale)[3].
La cicatrisation peut être exubérante avec formation d'une chéloïde.
À long terme, il peut exister une fragilisation de la peau, une dépigmentation.
Recherche
La cicatrisation naturelle des plaies importantes restaure l'homéostasie de la peau mais sans lui redonner toutes ses fonctionnalités, de même pour la greffe de culture de cellules de peau.
La science médicale recherche donc de nouvelles pistes et stratégies de restauration, si possible rapide, de suture et de cicatrisation. Parmi ces pistes figurent :
- l'ingénierie tissulaire qui peut aller jusqu'à imprimer en 3D des supports provisoires de biomatériaux vivants.
- la thérapie cellulaire, utilisant par exemple des cellules stromales mésenchymateuses (CSM), thérapies encore émergentes, car ces cellules souches isolées de différents tissus peuvent avoir des propriétés distinctes selon leur provenance.
Une étude récente (2020), sur le modèle murin a comparé l'utilisation potentielle des cellules stromales mésenchymateuses (CSM) dérivées du derme (CSD) et des CSM dérivées du tissu adipeux (CSA) avec l'objectif d'améliorer la cicatrisation des plaies cutanées. Des DSC et CSA humains ont été délivrés à des plaies de souris de pleine épaisseur par un échafaudage à base de collagène (Integra Matrix) : les DSC et les CSA ont accéléré et amélioré la cicatrisation, produisant une peau plus similaires à la peau saine[4].
Voir aussi
Articles connexes
Notes et références
- Roupé KM, Nybo M, Sjöbring U, Alberius P, Schmidtchen A, Sørensen OE, Injury is a major inducer of epidermal innate immune responses during wound healing, J Invest Dermatol, 2010;130:1167–1177
- Reinke JM, Sorg H, Wound repair and regeneration, Eur Surg Res, 2012;49:35–43
- Mustoe TA, O’Shaughnessy K, Kloeters O, Chronic wound pathogenesis and current treatment strategies: a unifying hypothesis, Plast Reconstr Surg, 2006;117(7 suppl):35S–41S
- Helena Debiazi Zomer, Talita da Silva Jeremias, Buddy Ratner et Andrea Goncalves Trentin, « Mesenchymal stromal cells from dermal and adipose tissues induce macrophage polarization to a pro-repair phenotype and improve skin wound healing », Cytotherapy, (ISSN 1465-3249, DOI 10.1016/j.jcyt.2020.02.003, lire en ligne, consulté le )
- Portail de la médecine