Citrate de magnésium
Le citrate de magnésium est une préparation de magnésium sous forme de sel avec de l'acide citrique dans un rapport 1:1 (1 atome de magnésium par molécule de citrate ). Le nom "citrate de magnésium" est ambigu et peut parfois faire référence à d'autres sels tels que le citrate de trimagnésium qui a un rapport magnésium/citrate de 3:2.
| Citrate de magnésium | |
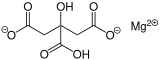
| |
| Identification | |
|---|---|
| Nom UICPA | 2-hydroxypropane-1,2,3-tricarboxylate de magnésium |
| No CAS | |
| No ECHA | 100.121.319 |
| No CE | 231-923-9 |
| Code ATC | A12, B05 |
| PubChem | 24511 |
| ChEBI | 131389 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C6H6MgO7 |
| Masse molaire[1] | 214,412 6 ± 0,007 9 g/mol C 33,61 %, H 2,82 %, Mg 11,34 %, O 52,23 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Le citrate de magnésium est utilisé en médecine comme laxatif salin et pour vider complètement l'intestin avant une intervention chirurgicale majeure ou une coloscopie . Il est disponible sans ordonnance, à la fois en tant que générique et sous diverses marques. Il est également utilisé sous forme de pilule comme complément alimentaire au magnésium. Il contient 11,23% de magnésium en poids. Comparé au citrate de trimagnésium, il est beaucoup plus soluble dans l'eau, moins alcalin et contient moins de magnésium.
En tant qu'additif alimentaire, le citrate de magnésium est utilisé pour réguler l'acidité et est connu sous le nom de numéro E E345.
Mécanisme d'action
Le citrate de magnésium agit en attirant l'eau à travers les tissus par un processus connu sous le nom d' osmose. Une fois dans l'intestin, il peut attirer suffisamment d'eau à l'intérieur pour provoquer la défécation. L'eau supplémentaire stimule la motilité intestinale. Cela signifie qu'il peut également être utilisé pour traiter les problèmes rectaux et du côlon. Le citrate de magnésium fonctionne mieux à jeun et doit toujours être suivi d'un verre plein (huit onces ou 250 ml) d'eau ou de jus pour aider le citrate de magnésium à s'absorber correctement et à prévenir toute complication. Les solutions de citrate de magnésium produisent généralement des selles en une demi-heure à trois heures. [2]
Utilisation et dosage
La limite supérieure de tolérance maximale (UTL) pour le magnésium sous forme de complément pour adultes est de 350 mg de magnésium par jour, selon les National Institutes of Health (NIH)[3]. De plus, selon le NIH, les besoins alimentaires totaux en magnésium de toutes les sources (c.-à-d. Aliments et compléments) sont de 320 à 420 mg de magnésium élémentaire par jour.
En tant que sirop laxatif avec une concentration de 0,06 g de citrate de magnésium par millilitre, une dose typique pour les adultes et les enfants de douze ans ou plus est comprise entre 210 et 300 ml, suivi immédiatement avec un plein verre d'eau de 240 ml. Consommer une dose adulte de 300 ml de sirop laxatif implique une consommation de 17,45 g de citrate de magnésium en une seule dose résultant en une consommation d'environ 2,0 g de magnésium par dose unique. Cette dose laxative contient cinq fois la dose nutritionnelle recommandée pour les enfants. L'utilisation du citrate de magnésium n'est pas recommandée chez les enfants et les nourrissons de deux ans ou moins.
Bien que longtemps moins courante, la forme citrate, en tant que complément du magnésium, est de plus en plus utilisée car on pense qu'elle est plus biodisponible que d'autres formes de pilules courantes[4], telles que l'oxyde de magnésium[5]. Cependant, selon une étude, le gluconate de magnésium est légèrement plus biodisponible que le citrate de magnésium[6].
Le citrate de magnésium sous forme de pilule, est utile pour la prévention des calculs rénaux[7] .
Effets secondaires
Le citrate de magnésium n'est généralement pas une substance nocive, mais des précautions doivent être prises en consultant un professionnel de la santé si des problèmes de santé indésirables sont suspectés ou ressentis. Une surdose extrême de magnésium peut entraîner de graves complications telles qu'un rythme cardiaque lent, une pression artérielle basse, des nausées, de la somnolence, etc. Si elle est suffisamment grave, une surdose peut même entraîner le coma ou la mort[8]. Cependant, un surdosage modéré sera excrété par les reins, à moins que l'on ait de graves problèmes rénaux. Des saignements rectaux ou une incapacité à aller à la selle après l'utilisation peuvent être des signes d'une maladie grave.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Magnesium Citrate », WebMD (consulté le )
- Magnesium. Office of Dietary Supplements (ODS). National Institutes of Health (NIH).
- https://www.passeportsante.net/fr/Solutions/PlantesSupplements/Fiche.aspx?doc=magnesium_ps
- Schuchardt et Hahn, « Intestinal Absorption and Factors Influencing Bioavailability of Magnesium- An Update », Current Nutrition & Food Science, vol. 13, no 4, , p. 260–278 (PMID 29123461, PMCID 5652077, DOI 10.2174/1573401313666170427162740, lire en ligne)
- Coudray, Rambeau, Feillet-Coudray et Gueux, « Study of magnesium bioavailability from ten organic and inorganic Mg salts in Mg-depleted rats using a stable isotope approach », Magnes Res, vol. 18, no 4, , p. 215–23 (PMID 16548135)
- Ettinger, Pak, Citron et Thomas, « Potassium-magnesium citrate is an effective prophylaxis against recurrent calcium oxalate nephrolithiasis », J Urol, vol. 158, no 6, , p. 2069–73 (PMID 9366314, DOI 10.1016/S0022-5347(01)68155-2)
- magnesium citrate. Cerner Multum. Drugs.com. 12 April 2009.
Voir aussi
- Code ATC A12
- Aspartate de magnésium
- Oxyde de magnésium