Connexine 26
La connexine 26, abrégé couramment CX 26, est une protéine transmembranaire dont le déficit donne l'une des formes les plus fréquentes de surdité d'origine génétique. Son gène est le GJB2 (« gap junction bêta 2 ») situé sur le chromosome 13 humain.
| Connexine 26 | ||
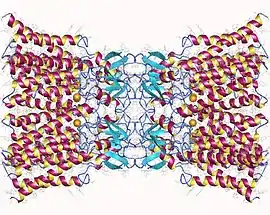 Dodécamère de connexine 26 humaine (PDB 5ER7[1]). | ||
| Caractéristiques générales | ||
|---|---|---|
| Nom approuvé | Gap Junction Protein Beta 2 | |
| Symbole | GJB2 | |
| Homo sapiens | ||
| Locus | 13q12.11 | |
| Masse moléculaire | 26 215 Da[2] | |
| Nombre de résidus | 226 acides aminés[2] | |
| Liens accessibles depuis GeneCards et HUGO. | ||
Structure
Le nombre « 26 » indique son poids en Kdaltons. Ces protéines constituent des jonctions communicantes (« gap junction ») entre les cellules de la cochlée, permettant, entre autres, la circulation des ions potassium[3].
la connexine 26 et la connexine 30 forment ainsi des canaux ioniques homotypiques ou hétérotypiques, chacun ayant leur propre propriété électrophysiologique[4], les hétérodimères 26-30 ayant une réponse au signal calcique plus rapide[5].
En médecine
Son déficit donne une surdité à transmission autosomique récessive[6]. Cette surdité peut être variable et progresser dans le temps[7].
Notes et références
- (en) Brad C. Bennett, Michael D. Purdy, Kent A. Baker, Chayan Acharya, William E. McIntire, Raymond C. Stevens, Qinghai Zhang, Andrew L. Harris, Ruben Abagyan et Mark Yeager, « An electrostatic mechanism for Ca2+-mediated regulation of gap junction channels », Nature Communications, vol. 7, , p. 8770 (PMID 26753910, PMCID 4730032, DOI 10.1038/ncomms9770, Bibcode 2016NatCo...7E8770B, lire en ligne)
- Les valeurs de la masse et du nombre de résidus indiquées ici sont celles du précurseur protéique issu de la traduction du gène, avant modifications post-traductionnelles, et peuvent différer significativement des valeurs correspondantes pour la protéine fonctionnelle.
- Kikuchi T, Kimura RS, Paul DL, Takasaka T, Adams JC, Gap junction systems in the mammalian cochlea, Brain Res Brain Res Rev, 2000;32:163–166
- Yum SW, Zhang JX, Valiunas V et al. Human connexin26 and connexin30 form functional heteromeric and heterotypic channels, Am J Physiol Cell Physiol, 2007;293:C1032–C1048
- Sun J, Ahmad S, Chen S et al. Cochlear gap junctions coassembled from Cx26 and 30 show faster intercellular Ca2+ signaling than homomeric counterparts, Am J Physiol Cell Physiol, 2005;288:C613–C623
- Kelsell DP, Dunlop J, Stevens HP et al. Connexin 26 mutations in hereditary non-syndromic sensorineural deafness, Nature, 1997;387:80–83
- Chan DK, Schrijver I, Chang KW, Connexin-26-associated deafness: phenotypic variability and progression of hearing loss, Genet Med, 2010;12:174–181
- Portail de la médecine
- Portail de la biologie cellulaire et moléculaire