Cyanhydrine
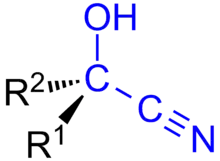
Une cyanhydrine (cyanohydrin en anglais) est un composé organique contenant un groupe hydroxyle et un groupe cyano sur le même atome de carbone.
Réactions
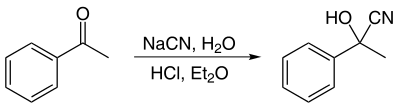
Les cyanhydrines peuvent être synthétisées par réaction entre de l'acide cyanhydrique (HCN) et une cétone ou un aldéhyde. L'acide cyanhydrique n'est normalement pas utilisé directement car c'est un gaz et qu'il est hautement toxique. Il est plus aisé d'utiliser un cyanure et un acide pour générer HCN in situ. Dans l'exemple ci-dessous, le mélange NaCN + HCl génère HCN et NaCl (parce que HCl est un acide beaucoup plus fort que HCN).
En milieu basique, les cyanhydrines se reconvertissent en carbonyle (RR'C=O) par perte de l'anion cyanure et reformation de la double liaison entre l'atome d'oxygène et de carbone[2]. Cette réaction est beaucoup plus facile pour les cyanhydrines de cétone que pour les cyanhydrines d'aldéhyde. Ceci permet d'utiliser la cyanhydrine d'acétone pour transférer HCN vers un aldéhyde[3].
L'oxygène du groupe hydroxyle perd facilement son proton acide et la paire d'électrons ainsi libérée peut devenir la liaison π du groupe carbonyle. L'anion cyanure part alors avec la paire d'électrons qui le liait au carbone du carbonyle.
Les cyanhydrines dans la nature
Les pépins de certains fruits contiennent des cyanhydrines.
Certains insectes stockent des cyanhydrines et les expulsent vers leur adversaire en mélange avec des enzymes qui libèrent l'acide cyanhydrique.
Notes et références
- Atrolactic acid - Organic Syntheses, Coll. Vol. 4, p.58 (1963); Vol. 33, p.7 (1953).
- Paula Yurkanis Bruice, Organic Chemistry, éd. Pearson Education, Inc., 5e éd., 2007, p. 805 (chap. 17 : Carbonyl Compounds II)
- Référence manquante
Voir aussi
Articles connexes
Lien externe
- (en) « cyanohydrine », IUPAC, Compendium of Chemical Terminology [« Gold Book »], Oxford, Blackwell Scientific Publications, 1997, version corrigée en ligne : (2019-), 2e éd. (ISBN 0-9678550-9-8)
- Portail de la chimie