Daphnie
Les daphnies sont de petits crustacés mesurant de un à quatre millimètres, du genre Daphnia. Elles vivent dans les eaux douces et stagnantes, quelques espèces supportant des conditions légèrement saumâtres. On peut apercevoir leurs organes internes grâce à leur corps translucide.
Daphnia

| Règne | Animalia |
|---|---|
| Embranchement | Arthropoda |
| Sous-embr. | Crustacea |
| Classe | Branchiopoda |
| Sous-classe | Phyllopoda |
| Ordre | Diplostraca |
| Sous-ordre | Cladocera |
| Infra-ordre | Anomopoda |
| Famille | Daphniidae |
Espèces de rang inférieur
- sous-genre Daphnia
- D. ambigua
- D. arenata
- D. catawba
- D. cheraphila
- D. latispina
- D. melanica
- D. middendorffiana
- D. minnehaha
- D. neo-obtusa
- D. obtusa
- D. oregonensis
- D. parvula
- D. pileata
- D. prolata
- D. pulex
- D. pulicaria
- D. retrocurva
- D. tenebrosa
- D. villosa
- sous-genre Hyalodaphnia
- D. curvirostris
- D. dentifera
- D. dubia
- D. laevis
- D. longiremis
- D. mendotae
- D. thorata
- D. umbra
- sous-genre Ctenodaphnia
- D. brooksi
- D. ephemeralis
- D. exilis
- D. lumholtzi
- D. magna
- D. salina
- D. similis
Leur nom populaire de « puce d'eau » donne une bonne idée de leur taille, de leur forme et de leur façon d’évoluer dans l’eau.
Étymologie
Le mot Daphnie vient du latin scientifique daphnia tiré du grec ancien δάφνη (daphnè), « laurier », par comparaison de la forme de l'animal avec la feuille de laurier.
Description

Elles possèdent :
- un corps transparent, trapu et en forme de goutte d'eau asymétrique, protégé par une carapace translucide ;
- de grandes antennes plumeuses, utilisées pour la nage ;
- un seul œil (en réalité constitué de deux yeux réunis) ;
- cinq minuscules paires de pattes reliées au thorax.
Leur couleur varie selon l'espèce et l'environnement ; de rougeâtre à vert, en passant par différentes nuances de bleuté ou jaunâtre. Les individus rougeâtres (teinte rosée en général) ont une lymphe qui contient de l'hémoglobine qui les rend plus adaptés aux faibles taux d'oxygène, voire — temporairement au moins — à des conditions d'hypoxie sévère (~0,2 mg d'oxygène par litre)[1].
Le nombre de gènes dans le génome d'une puce d'eau est 31 000 contre 23 000 dans le génome d'un humain.
Habitat
Les daphnies vivent dans les points d’eau douce stagnante (étangs, lacs, mares plutôt en milieu forestier ou boisé, en présence de feuilles mortes sur le fond). Plusieurs centaines d'espèce de daphnies ont colonisé de nombreux types de milieux. Elles cohabitent souvent avec les cyclops, divers copépodes et des larves de chironomidés avec lesquelles elles constituent l'essentiel du zooplancton des eaux douces tempérées.
Quelques espèces supportent des eaux légèrement saumâtres. Par exemple, Moina macrocopa peut développer des populations viables dans une salinité supérieure à quatre pour mille[2].
Importance
Les daphnies jouent un rôle majeur dans le cycle des nitrates et phosphates dans l'eau, et donc en matière d'autoépuration des eaux stagnantes. Elles sont aussi un régulateur efficace du phytoplancton, tant que les nutriments ne sont pas présents en quantité trop élevée. Elles sont une source d'alimentation importante pour de nombreuses espèces aquatiques et semi-aquatiques.
Les daphnies montent et descendent dans la colonne d'eau de manière rythmique en fonction de la luminosité et des cycles nycthéméraux ; en l'absence de poissons et de mouvements de convection, notamment dans les mares forestières et de vallées peu exposées au vent, par le mouvement constant de leurs antennes natatoires et par les microturbulences qu'elles engendrent ainsi dans la colonne d'eau, elles contribuent :
- à la dispersion du phytoplancton et d'autres microorganismes,
- au mélange des gradients thermiques,
- au mélange des couches plus ou moins oxygénées (le taux d'oxygène dissous varie notamment avec la température),
- au mélange des couches de salinité ou densité différente, ce qui diminue le risque de présence d'eaux mortes induites par des phénomènes d'anoxie ou de température trop élevée.
Les grands cladocères contribuent aux équilibres écologiques :
- comme source de nourriture (particulièrement riche en protéines) pour de nombreuses espèces ;
- en filtrant l'eau pour se nourrir et en assurant ainsi un contrôle des populations phytoplanctoniques et de diverses ciliés (paramécies) et bactéries, de l'eau. Ces organismes entretiennent la clarté des mares et des zones humides eutrophes ou mésotrophes où elles sont présentes, permettant une meilleure pénétration de la lumière dans les couches profondes de la colonne d'eau. Daphnia magna peut par exemple filtrer et manger plusieurs milliers de petites algues vertes par heure[3], ce qui correspond à une filtration atteignant 80 ml en 24 heures, soit une capacité de filtration de 1 litre d'eau en 24 heures pour 12,5 individus ;
- en permettant une désinfection de l'eau accrue par les rayons UV solaires grâce à leur capacité de filtration très efficace ;
- en limitant les pullulations d'algues filamenteuses de surface (tant que les nitrates et phosphates ne sont pas surabondants).
Dans les eaux stagnantes et très poissonneuses (ex : mares empoissonnées pour une pisciculture de rente ou pêche de loisirs), les cladocères régressent au profit des copépodes qui, avec les rotifères, ne peuvent efficacement réguler les populations de phytoplancton, ce qui entraîne une augmentation de la turbidité de l'eau, et d'éventuels déséquilibres.
Les daphnies ne supportent pas les eaux très acides et/ou très peu minéralisées.
Alimentation
Les daphnies filtrent l'eau et capturent de minuscules organismes planctoniques à l'aide d'un filtre de maille inférieure au micromètre, placé en entrée de leur système digestif. Ce système est similaire au fanon des baleines.
Locomotion et migrations verticales
La daphnie se déplace en battant simultanément des deux antennes. Sa nage saccadée, par soubresauts, lui a valu le surnom de « puce d’eau » bien qu'elle ne pique pas et soit sans danger pour l'homme et autres animaux.
Les nuages de daphnies donnent l'impression d'une somme de comportements natatoires individuels aléatoires, mais ces populations changent de comportement à l'aube et au crépuscule sous l'effet de la variation de luminosité[4] et elles effectuent de lentes migrations horizontales et verticales (nycthémérales) qui semblent guidées par l'éclairement, les cycles jour/nuit et lunaires, la température, la salinité de l'eau[5], et des phénomènes discrets de convection[6] de l'eau. L'œil de la daphnie lui permet de se caler sur ces cycles et joue un rôle fondamental : il est de jour protégé par des pigments photoprotecteurs qui disparaissent en partie la nuit, lui permettant probablement de continuer à bien voir par exemple grâce à la lumière de la lune. « L'alternance jour/nuit en lumière bleue inhibe les migrations verticales des daphnies et les variations de densité pigmentaires ne sont plus significatives », ce qui plaide en faveur d'une participation fonctionnelle de l’œil à l'horloge interne[7].
Comme pour d'autres invertébrés aquatiques :
- Des variations structurales et/ou ultrastructurales de l'œil surviennent au moment du lever et du coucher du soleil (phénomène observées chez de nombreux Cladocères[8].
- un éclairement correspondant à la moitié de celui de la pleine lune (moins de 0,1 lux) suffit à influencer la migration verticale nycthémérale. La pollution lumineuse pourrait donc aussi perturber cette espèce, avec des conséquences écologiques potentiellement graves, telles que le développement d'algues de surface susceptibles d'appauvrir et dégrader les zones humides où les daphnies seraient ainsi perturbées[9]. Il a été montré La lumière bleue inhibe la migration verticale de Daphnia.
Perception de l'environnement
- La daphnie est dotée d'yeux.
- Elle est dotée de chemorécepteurs qui lui permettent notamment de capter les kairomones de poissons (molécules émises dans l'eau par la peau ou les excrétions des poissons, prédateurs de daphnies). Ces kairomones semblent jouer un rôle d'alarme, mais sont aussi un facteur de stress[10]. L'exposition de daphnies en laboratoire à six kairomones différentes (de poissons) peut diminuer la durée de vie de l'individu, mais améliorer la survie de l'espèce en présence de poissons. Selon les études faites in vitro (avec des clones de l'hybride Daphnia x hyalina galeata) l'exposition à ces kairomones modifie fortement les paramètres du cycle de vie de la daphnie, dont : l'âge et la taille à maturité, la taille du nouveau-né et le nombre d’œufs de la première ponte. La daphnie se fait plus discrète en présence de poissons : la taille du nouveau-né diminue linéairement quand le taux de kairomone croît dans l'eau[10]. Des nouveau-nés de mères non cultivées en présence de kairomones sont plus grands, et vivent plus longtemps[10]. Ceci montre que la daphnie peut ainsi contribuer aux équilibres prédateurs-proies et ajuster ses traits d'histoire de vie à différents niveaux de kairomones, c'est-à-dire à des densités de poissons différents (risque a priori augmenté de prédation)[10].
- Remarque : s'il existe des pseudo-kairomones, comme il existe des pseudo-hormones (perturbateurs endocriniens), ils doivent également pouvoir perturber les dynamiques de populations des espèces qui y sont sensibles, et par suite des espèces qui en dépendent ou qui y sont liées par des interactions durables.
Cyclomorphose
Les daphnies connaissent comme tous les crustacés des mues périodiques. Mais elles sont aussi des polymorphes saisonnières (elles changent de forme selon la saison). Pour cette raison, seules les grandes femelles permettent d'identifier avec certitude une espèce.
Cette cyclomorphose est contrôlée par plusieurs facteurs (température, turbulence, turbidité et salinité du milieu).
Reproduction
La daphnie ou puce d'eau se multiplie de façon exponentielle au printemps[11].
Ce minuscule crustacé connaît deux modes de reproduction (sexuée et asexuée) :
- reproduction asexuée : ce mode prévaut quand les conditions de vie sont optimales. Les femelles, sans fécondation, produisent par parthénogenèse, environ de trois à cinquante œufs par semaine, qui vont éclore dans une « poche incubatrice ». Ces œufs ne donneront naissance qu'à des femelles.
- reproduction sexuée : quand les conditions de vie deviennent défavorables (froid, manque de proies, stress, forte densité de population, anoxie, dystrophisation…), les daphnies donnent naissance à une génération composée de mâles et de femelles. Après fécondation, deux œufs (dits « de résistance », « de durée » ou « de survie », ou « éphippie » ou « ephippium », comparables aux cystes d'Artemia salina) sont produits.
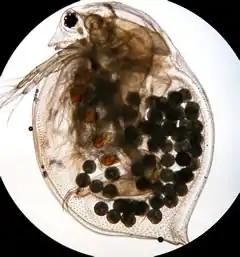 Les points noirs sont les œufs produits en mode asexué (parthénogenèse) par Daphnia magna.
Les points noirs sont les œufs produits en mode asexué (parthénogenèse) par Daphnia magna.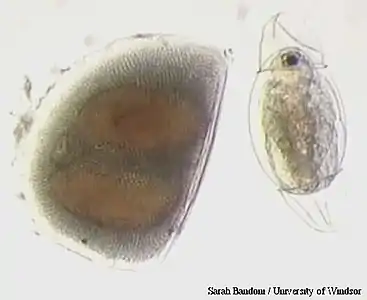
Les œufs
Les œufs « vrais » ou éphippies[12] sont ceux qui sont issus de la reproduction sexuée. Ils sont produits en quantité bien moindre qu'en mode de reproduction parthénogénétique, mais ils sont beaucoup plus résistants. Ils résistent au gel (pour certaines espèces uniquement), à une certaine pression d'écrasement et de friction, ainsi qu'à la dessiccation. Protégés par leur membrane, ces œufs attendront les conditions favorables pour éclore ; chaque paire de ces œufs donnera naissance à deux femelles qui engendreront une nouvelle descendance, uniquement composée de femelles tant que les conditions du milieu seront optimales pour l'espèce.
Transportées par les oiseaux, sous les pattes d'animaux ou via les inondations, ces éphippies sont des propagules de colonisation ou de recolonisation de mares et zones humides, entretenant les échanges et la diversité génétique au sein d'une métapopulation.
L'œuf (éphippie) éclot (éventuellement après réhydratation) si l'eau est suffisamment oxygénée et a une température suffisante (conditions variant selon l'espèce concernée).
État des populations, statut, menaces
Bien que très résistantes, les daphnies régressent localement (ou disparaissent) face à certaines formes de pollution (pesticides et insecticides en particulier).
Les nitrates et phosphates, quand ils sont cause de dystrophisation, peuvent aussi conduire, provisoirement au moins, à une raréfaction ou disparition des daphnies.
Les daphnies pourraient être sensibles à la pollution lumineuse.
L'éclairement d'un plan d'eau, même à de faibles intensités lumineuses (inférieures à 0,1 lux, soit l'équivalent de 50 % de la lumière renvoyée par une pleine lune) suffit en effet à affecter le déplacement vertical du zooplancton dans la colonne d'eau. Or cette migration biquotidienne est fonctionnellement importante pour l'espèce et pour l'écosystème, avec de possibles conséquences secondaires, dont
- développement de blooms phytoplanctoniques, éventuellement toxiques,
- apparition d'algues en surface qui bloquent le rayonnement solaire, et peuvent dégrader le milieu (dystrophisation ; moindre désinfection naturelle de l'eau par les UV, etc.)[13],
- perte de biodiversité et recul d'espèces dépendant des daphnies pour leur nourriture (larves de tritons par exemple).
Les daphnies pourraient aussi être affectées par des perturbateurs endocriniens. En bioaccumulant certains toxiques, elles peuvent contribuer à la concentration de certains toxiques dans les chaines alimentaires.
L'état des populations des diverses espèces ne semble pas avoir fait l'objet d'un suivi permettant d'évaluer une éventuelle menace de disparition pour les espèces les plus rares de daphnies. De plus, la résistance de leurs œufs et une bonne capacité à recoloniser des milieux isolés semblent conférer une certaine résilience aux métapopulations de daphnies.
Usages
Pour leur richesse en protéines et en acides aminés (dont arginine (10,92 %)[14]), les daphnies sont utilisées (vivantes ou lyophilisées) par les aquariophiles comme nourriture pour les poissons d'aquarium, car réputées faciliter leur digestion[réf. nécessaire] (surtout pour les poissons rouges).
Les daphnies sont attirées par la lumière ; faire de l'ombre avec sa main au-dessus de l'eau les fait fuir et une lampe de poche la nuit les attire. Sensibles à de faibles intensités lumineuses, elles font partie des espèces perturbées par la pollution lumineuse.
Utilisation scientifique
La daphnie est aussi un bioindicateur.
En écotoxicologie, elle est couramment utilisée pour étudier la qualité de l'eau, et sa capacité à permettre la survie du zooplancton. Elle est couramment utilisée afin de mener des essais d'écotoxicité aiguë ou chronique de substances soupçonnées d'être dangereuses pour l'environnement.
La Daphnia pulex est le premier crustacé au génome séquencé : il compte 31 000 gènes contre 23 000 pour l'homme[15], ce qui fait de cette puce d'eau un organisme modèle pour la génomique comparative et environnementale[16].
Liste des espèces
Selon ITIS (18 février 2016)[17] :
- Daphnia ambigua Scourfield, 1947
- Daphnia arcuata Forbes, 1893
- Daphnia brooksi Dodson, 1985
- Daphnia carinata
- Daphnia carvicervix Ekman
- Daphnia catawba Coker, 1926
- Daphnia cheraphila Hebert & Finston, 1996
- Daphnia cucullata
- Daphnia curvirostris Eylman, 1887
- Daphnia dubia Herrick, 1883
- Daphnia exilis Herrick, 1895
- Daphnia galeata G. O. Sars, 1864
- Daphnia hyalina
- Daphnia laevis Birge, 1879
- Daphnia latispina Korinek & Hebert, 1996
- Daphnia longiremis G. O. Sars, 1861
- Daphnia longispina (O. F. Mueller, 1785)
- Daphnia lumholtzi G. O. Sars, 1885
- Daphnia magna Straus, 1820
- Daphnia magniceps Herrick, 1884
- Daphnia middendorffiana Fischer, 1851
- Daphnia minnehaha Herrick, 1884
- Daphnia obtusa Kurz, 1875
- Daphnia oregonensis Korinek & Hebert, 1996
- Daphnia parvula Fordyce, 1901
- Daphnia pileata Hebert & Finston, 1996
- Daphnia prolata Hebert & Finston, 1996
- Daphnia psittacea (Baird, 1850)
- Daphnia pulex Leydig, 1860
- Daphnia pulicaria Forbes, 1893
- Daphnia retrocurva Forbes, 1882
- Daphnia rosea G. O. Sars, 1862
- Daphnia salina Hebert & Finston, 1993
- Daphnia schodleri G. O. Sars, 1862
- Daphnia similis Claus, 1876
- Daphnia tenebrosa G. O. Sars, 1898
- Daphnia thorata Forbes, 1893
- Daphnia villosa Korinek & Hebert, 1996
 Daphnia longispina (gravide).
Daphnia longispina (gravide).

Notes et références
- (en) « Effect of oxygen concentration on metabolism and locomotory activity of Moina micrura (Cladocera) cultured under hypo- and normoxia », Marine Biology, Springer Berlin / Heidelberg. (ISSN 0025-3162) (papier) 1432-1793 (en ligne), vol. 141, no 1, juillet 2002, DOI:10.1007/s00227-002-0805-x, p. 145-151.
- Ivleva, 1969
- J . Sevrin-Reyssac et F. Delsalle
- (en) Grover P. B.& Miller R. J. (1984) Effects of Crepuscular Photoenvironment on Light-Induced Behavior of Daphnia. Physiology & Behavior, 33 : 729-732
- Berthon J. L. (1988) Contenu énergétique, migrations et stratégies du zooplancton lacustre. Thèse Univ. de Saint-Etienne :313 p.
- Angeli N., Pont D. & Pourriot R. (1995). Hétérogénéité spatiale et migration du plancton, in Limnologie générait. Pourriot R. & Meybeck (eds) M. Masson, Collection d'écologie 25, Paris : p. 411-440.
- Cellier, S., Rehaïlia, M., Berthon, J. L., & Buisson, B. (1998). Le rôle de l'œil, dans les rythmes migratoires de Daphnia magna et Daphnia longispina (Cladocères). Annales de Limnologie-International Journal of Limnology, (vol. 34, no 2, p. 159-164), juin 1998 EDP Sciences.
- (en) D. E. Nilsson et R. Odselius (1981), « A new mechanism for lightdark adaptation in the Anemia compound eye (Anostraca, Crustacea) », J. Comp. Physiol., 143, p. 389-399.
- (en) Travis Longcore et Catherine Rich, « Ecological light pollution », Frontiers in Ecology and the Environment 2 : p. 191-198 (www.frontiersinecology.org), cités par Marc Théry (CNRS)
- (en) T. Reede (1995), Life history shifts in response to different levels of fish kairomones in Daphnia ; Oxford Univ Press, Journal of plankton research. (1995) 17 (8), p. 1661-1667. doi: 10.1093/plankt/17.8.1661 (résumé)
- Collectif (trad. Manuel Boghossian), Le règne animal, Gallimard Jeunesse, , 624 p. (ISBN 2-07-055151-2), Daphnies page 579
- Les daphnies, des proies parfaites
- Voir synthèse de Marc Théry (CNRS), ou article « Ecological light pollution », de Travis Longcore et Catherine Rich dans la revue Frontiers in Ecology and the Environment 2 : 191 - 198
- (en) Shawn Coyle et al., « A Preliminary Evaluation of Naturally Occurring Organisms, Distillery By-Products, and Prepared Diets as Food for Juvenile Freshwater Prawn Macrobrachium rosenbergii », 1996, p. 57-66, DOI: 10.1300/J028v06n02_05, Journal of Applied Aquaculture', vol. 6, no 2, (ISSN 1045-4438) Pub date : 18 juillet 1996.
- (en) John Kenneth Colbourne et coll, « The Ecoresponsive Genome of Daphnia pulex », Science,
- (en) Daphnia genomics Consortium Collaboration Wiki
- Integrated Taxonomic Information System (ITIS), www.itis.gov, CC0 https://doi.org/10.5066/F7KH0KBK, consulté le 18 février 2016
Voir aussi
Bibliographie
- (en) Anderson, B. et J. Jenkins. 1942. A Time study of Events in the Life Span of Daphnia magna. The Biol. Bull, 83 (1) : p. 260–272.
- (en) Hebert, P. 1978. The Population Biology of Daphnia. Biol. Rev. 53 : p. 387–426.
- (es) Reartes, J. 1983. Empleo de salvado de arroz y agua de porquerizas en cultivos masivos de Daphnia magna Straus. Mem. Asoc. Latinoam. Acuicult., 5 (2) : p. 361–367.
- (en) Taub, F. et A. Dollar. 1968. The nutritional inadequacy of Chlorella and Chlamydomonas as food for Daphnia pulex. Limnol. Oceanogr., 13 (4) : p. 607–617.
- (en) Tappa, D. 1965. The dynamics of the association of six limnetic species of Daphnia in Azicoos lake, Main. Ecol. Monogr., 35 : p. 395–423.
- (en) Tezuka, Y. 1974. An experimental study on the food chain among bacteria, Paramecium y Daphnia. Int. Revue ges. Hydrobiol., 59 (1) p. 31–37. Ventura, R. and E. Enderez. 1980. Preliminary studies on Moina sp. production in freshwater tanks. Aquaculture, 21 : p. 93–96.
Articles connexes
Liens externes
- Notices dans des dictionnaires ou encyclopédies généralistes :
- Ressource relative à la santé :
- Ressources relatives au vivant :
- Global Biodiversity Information Facility
- (en) Animal Diversity Web
- (en) ARKive
- (en) Australian Faunal Directory
- (en) BugGuide
- (sv) Dyntaxa
- (en) EPPO Global Database
- (en) EU-nomen
- (en) Fauna Europaea
- (en) Paleobiology Database
- (mul + en) iNaturalist
- (en) Interim Register of Marine and Nonmarine Genera
- (en) Invasive Species Compendium
- (en) NBN Atlas
- (nl) Nederlands Soortenregister
- (en + en) New Zealand Organisms Register
- (en) Plazi
- (en) Système d'information taxonomique intégré
- (en) Universal Biological Indexer and Organizer
- (en) World Register of Marine Species
- (en) Référence Paleobiology Database : Daphnia Muller 1785
- (fr+en) Référence ITIS : Daphnia O.F. Müller, 1785
- (en) Référence Catalogue of Life : Daphnia
- (en) Référence Fauna Europaea : Daphnia
- (en) Référence BioLib : Daphnia O.F. Müller, 1785
- Portail de la biologie
- Portail de la carcinologie et des crustacés
- Portail de la biologie marine