Deltaméthrine
La deltaméthrine est un composé chimique de la famille des pyréthrinoïdes. Utilisée principalement comme insecticide et répulsif pour les insectes ou les serpents en raison de ses propriétés neurotoxiques.
| Deltaméthrine | |
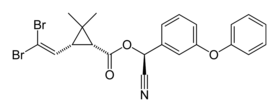
| |
| Structure | |
| Identification | |
|---|---|
| Nom UICPA | (1R,3R)-3-(2,2-dibromovinyl)-2,2-diméthyl-cyclopropane carboxylate de (S)-α-cyano-3-phénoxybenzyle[1] |
| Synonymes |
décaméthrine |
| No CAS | |
| No ECHA | 100.052.943 |
| No CE | 258-256-6 |
| Code ATC | P03 |
| SMILES | |
| InChI | |
| Apparence | poudre cristalline incolore, inodore[2]. |
| Propriétés chimiques | |
| Formule | C22H19Br2NO3 [Isomères] |
| Masse molaire[3] | 505,199 ± 0,022 g/mol C 52,3 %, H 3,79 %, Br 31,63 %, N 2,77 %, O 9,5 %, |
| Propriétés physiques | |
| T° fusion | 100-102 °C[4] |
| Solubilité | eau: <0,2 μg/l (25 °C) |
| Masse volumique | 0,5 g·cm-3[4] |
| Point d’éclair | 100 °C[4] |
| Précautions | |
| SGH[5] | |
  Danger |
|
| Transport | |
| Classification du CIRC | |
| Groupe 3 : Inclassable quant à sa cancérogénicité pour l'Homme[6] | |
| Unités du SI et CNTP, sauf indication contraire. | |
La deltaméthrine est produite par action du tétrabromure de carbone sur la cyperméthrine
Réglementation
Sur le plan de la réglementation des produits phytopharmaceutiques :
- pour l’Union européenne : cette substance active est inscrite à l’annexe I de la directive 91/414/CEE par la directive 2003/5/CE.
- pour la France : cette substance active est autorisée dans la composition de préparations bénéficiant d’une autorisation de mise sur le marché.
La teneur maximale autorisée en résidus de deltaméthrine dans les céréales est de 2 mg·kg-1[7].
Toxicologie
Cette molécule synthétique est rangée parmi les pyréthrinoïdes dits « de type II » c'est-à-dire non seulement dérivés d'une molécule naturelle qui a été rendue plus résistante aux UV solaires, mais dont les chimistes ont encore accru l'effet insecticide en leur adjoignant un groupement cyano en position 1 de la partie alcool ; combinée à la modification successive de la nature des groupements halogénés (comme cela a été fait pour d'autres molécules comme la cyperméthrine et la cyfluthrine[8])[9]
Au sein du groupe des pyréthrinoïdes la deltaméthrine se classe parmi les plus toxiques et écotoxiques. Elle n'a pas d'isomères et sa DL 50 par voie orale chez le rat mâle est de 95 mg/kg (à comparer à celles de la perméthrine ou de la cyperméthrine qui dans les mêmes conditions expérimentales sont de 1200 et 297 mg/kg[10].
Elle est dégradée dans l'organisme par des enzymes, en sous-produits (métabolites) pouvant eux-mêmes être toxiques[11],[12],[13]. parmi les métabolites parfois recherchés figurent le DBCA (spécifique d’une exposition à la deltaméthrine) et le trans-DCCA (qui est aussi un métabolite de la cyfluthrine, de la cyperméthrine et de la perméthrine).
Toxicité pour l'humain et les animaux à sang chaud
Elle est mal étudiée mais on sait par l'étude d'effets d'expositions professionnelles chroniques (vaporisation des cultures ou utilisation au laboratoire), accidentelles ou suite des cas de tentative de suicide) que les symptômes varient considérablement selon la dose (le solvant a aussi une grande importance : la Deltaméthrine est beaucoup plus toxique dans un solvant huileux ou gras que diluée dans de l'eau, à dose égale), mais aussi selon la voie d’exposition (ingestion, inhalation, passage percutané). Chez le rat, la DL50 de la deltaméthrine est de 95 mg/kg si elle est diluée dans de l'huile de maïs et de plus de 5 000 mg/kg dans de l’eau[10]. Dans les années 2010, l'INVS considère que tous les Français présentent des traces de Deltaméthrine et/ou de ses métabolites dans leur urine (le 3-PBA étant le métabolite le plus présent, devant le trans-DCCA)[9]. Une étude (2014) a recherché dans le méconium de nouveau-nés picards la deltaméthrine, sans en trouver (alors que de la cyfluthrine et la cyperméthrine étaient présentes[14]). L'analyse a cependant détecté 22 ng/g de DCCA (qui peut en être un produit de dégradation de la deltaméthrine, ainsi que d'autres pesticides de la même famille)[15].
La littérature signale :
- des sensations cutanées anormales. Selon la littérature une exposition à des produits proches (cyperméthrine, perméthrine, fenvalerate ou fenpropathrine) provoque des picotements, des brûlures au visage 30 min à 3 h après une exposition cutanée professionnelle ou accidentelle, même faible (quelques gouttes) ; l'effet disparait après un jour ou moins.
- après ingestion de hautes dose de deltaméthrine (5 à 500 mL d’une émulsion à 2,5 %), fenvalerate (10 à 500 mL d’une émulsion à 20 %) ou cyperméthrine (10 à 70 mL d’une émulsion à 10 %) apparaissent des vertiges, des maux de tête et des nausées et vomissements, avec parfois des paresthésies, palpitations, une oppression thoracique (He et al. 1989). Avec la perméthrine (molécule proche et réputée moins toxique) des convulsions et le coma peuvent survenir dans certains cas selon Gotoh (1998)[16] et Yang et al. (2002)[17].
- des lésions histologiques et métabonomiques hépatiques et rénales que Bhushan et al. 2013; Liang et al. 2013 considèrent être de nouveaux marqueurs d’exposition aux pyréthrinoïdes
(chez des rats chroniquement oralement exposés durant 2 mois (60 jours) à la perméthrine ou à la deltaméthrine respectivement à 12 et 75 mg/kg/j et 1,02 et 6,4 mg/kg/j. Des modifications au niveau urinaire et sérologique de certains composés organiques et sels confirmaient la présence de lésions rénales et hépatiques. En 1988, aucun effet carcinogène n'avait été signalé (Ishmael and Litchfield 1988).
Toxicité pour la faune aquatique
La deltaméthrine est extrêmement toxique chez les poissons et les invertébrés d'eau douce.
Elle a un fort potentiel de bioaccumulation dans les tissus des organismes aquatiques[18].
- À des taux de 10–50 μg/litre, la deltaméthrine inhibant la capacité de filtration des mollusques bivalves tels que les moules (et donc leur capacité de s'alimenter), les scientifiques recommandent d'en surveiller l'utilisation agricole dans les zones aquatiques[19].
Le 26 mai 2010, l'association environnementale Bassin d'Arcachon Écologie (agréée au titre de l'article L.141-1 du Code de l'Environnement) a demandé au Préfet de Gironde l'abandon de la deltaméthrine pour le démoustiquage dans la région[20].
Toxicité pour les abeilles
La deltaméthrine, même à faible dose est toxique pour l'abeille.
La DL50 aiguë par contact est de 0,067 µg/abeille[18].
Toxicité sur les chats et chiens
Cette molécule étant très utilisée comme produit imprégnant des colliers antiparasitaires, une thèse (2003) a recherché (sans en trouver) d'éventuelles interférences négatives ou positives avec la qualité de l'odorat des chiens dits d’utilité publique (utilisés pour leur odorat notamment par les forces de l'ordre, la sécurité civile ou la médecine)[21]
Comme tous les pyréthrinoïdes, la perméthrine peut avoir des effets toxiques chez le chat et le chien (corrélée à la dose et la voie d’exposition[22], et probablement selon l'âge de l'animal (chez lequel l’activité enzymatique n’est pas encore mature, faisant que la deltaméthrine persistera plus longtemps dans l'organisme selon Cantalamessa 1993 et Kim et al. 2010)). Ces effets sont en cours d'étude, dont pour leurs produits secondaires via des animaux de laboratoire[23],[24].
Usages
En France la deltaméthrine a notamment été utilisée en grande quantité en 2007 / 2008 en pulvérisation aérienne pour lutter contre la chrysomèle des racines du maïs.
Le département de la Gironde en prévoit l'utilisation pour la démoustication dans le cadre du plan antidissémination de la dengue et du chikungunya[25].
L'ARS de la Réunion l'utilise également dans le cadre de ses opérations de démoustication dans le but de lutter contre l'épidémie de dengue.
Elle a été récemment (2019) proposée sous forme nano-encapsulée comme synergisant chimique de l'insecticide indoxacarbe[26]
Références
- [PDF]Delthamétrine, fiche toxicologique 193, édition 1987,INRS
- DELTAMETHRINE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 52918-63-5 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 6 décembre 2008 (JavaScript nécessaire)
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- IARC Working Group on the Evaluation of Carcinogenic Risks to Humans, « Evaluations Globales de la Cancérogénicité pour l'Homme, Groupe 3 : Inclassables quant à leur cancérogénicité pour l'Homme », sur monographs.iarc.fr, CIRC, (consulté le )
- « Teneurs maximales en résidus de pesticides admissibles sur et dans les céréales », Arrêté du 17 décembre 2007
- Lawrence, L. J., and Casida, J. E. (1982). Pyrethroid toxicology: Mouse intracerebral structure-toxicity relationships. Pesticide Biochemistry and Physiology 18, 9-14.
- Willemin M.E (2014). Modélisation de la toxicocinétique des isomères cis et trans de la perméthrine et de ses métabolites chez le rat et de leur métabolisme sur hépatocytes humains ; Thèse de Doctorat (Biomécanique, Bio-ingénierie), Université technique de Compiègne, soutenue le 21 novembre 2014
- Soderlund, D. M., Clark, J. M., Sheets, L. P., Mullin, L. S., Piccirillo, V. J., Sargent, D., Stevens, J. T., and Weiner, M. L. (2002). Mechanisms of pyrethroid neurotoxicity: implications for cumulative risk assessment. Toxicology 171, 3-59.
- Anand, S. S., Bruckner, J. V., Haines, W. T., Muralidhara, S., Fisher, J. W., and Padilla, S. (2006). Characterization of deltamethrin metabolism by rat plasma and liver microsomes. Toxicology and Applied Pharmacology 212, 156-166.
- Godin, S. J., Crow, J. A., Scollon, E. J., Hughes, M. F., DeVito, M. J., and Ross, M. K. (2007). Identification of rat and human cytochrome P450 isoforms and a rat serum esterase that metabolize the pyrethroid insecticides deltamethrin and esfenvalerate. Drug Metabolism and Disposition 35, 1664-1671.
- Godin, S. J., Scollon, E. J., Hughes, M. F., Potter, P. M., DeVito, M. J., and Ross, M. K. (2006). Species differences in the in vitro metabolism of deltamethrin and esfenvalerate: Differential oxidative and hydrolytic metabolism by humans and rats. Drug Metabolism and Disposition 34, 1764-1771.
- respectivement de 424 ng/g et 188 ng/g
- Berton, T., Mayhoub, F., Chardon, K., Duca, R.-C., Lestremau, F., Bach, V. r., and Tack, K. (2014). Development of an analytical strategy based on LC-MS/MS for the measurement of different classes of pesticides and theirs metabolites in meconium: Application and characterisation of foetal exposure in France. Environmental Research 132, 311-320.
- Gotoh, Y., Kawakami, M., Matsumoto, N., and Okada, Y. (1998). Permethrin emulsion ingestion: Clinical manifestations and clearance of isomers. Journal of Toxicology-Clinical Toxicology 36, 57-61.
- Yang, P. Y., Lin, J. L., Hall, A. H., Tsao, T. C., and Chern, M. S. (2002). Acute ingestion poisoning with insecticide formulations containing the pyrethroid permethrin, xylene, and surfactant: a review of 48 cases. Journal of Toxicology - Clinical Toxicology 40, 107-13.
- « Effets toxiques des matières actives », sur sagepesticides.qc.ca (consulté le )
- « Short- and Long-Term Effects of Deltamethrin on Filtering Activity of Freshwater Mussel », Ecotoxicology and Environmental Safety, Volume 38, Issue 3, December 1997, Pages 195-199
- « Mais qui protège-t-on des moustiques ? »
- deltaméthrine Roqueplo C (2003) Influence du port d’un collier antiparasitaire contenant de la deltaméthrine sur les performances olfactives du chien (Thèse de doctorat vétérinaire; Faculté de médecine de Créteil–École nationale vétérinaire de Maisons-Alfort) ; 183p).
- « Effets indésirables et intoxication par les pyréthrinoïdes utilisés contre les ectoparasites chez le chien et le chat », sur Centre Belge d'Information Pharmacothérapeutique (C.B.I.P.) (consulté le )
- Willemin, M., Robidel, F., Lecomte, A., Chatellier, C., Le Grand, R., Zeman, F., ... & Brochot, C. (2013, June). Développement d'un modèle toxicocinétique de la cis et trans-perméthrine et de trois métabolites chez le rat. In Colloque Modèles biologiques mathématiques.
- Willemin, M. É. (2014). Modélisation de la toxicocinétique des isomères cis et trans de la perméthrine et de ses métabolites chez le rat et de leur métabolisme sur hépatocytes humains (Doctoral dissertation, Compiègne).
- « Projet d'arrêté préfectoral relatif aux modalités de mise en œuvre en Gironde du plan antidissémination du chikungunya et de la dengue en métropole », sur gironde.gouv.fr (consulté le )
- Pitti Caballero, J. E. (2019). Nanoencapsulation d’un agent synergisant chimique, la deltaméthrine pour potentialiser l’effet d’un insecticide, l’indoxacarbe contre les insectes nuisibles (Doctoral dissertation, Angers).
Liens externes
- Portail de la chimie
- Portail de l’agriculture et l’agronomie
- Portail de la parasitologie
- Portail de la pharmacie
- Portail de la protection des cultures
- Portail de l’entomologie
