Diagramme de Davenport
Le Diagramme de Davenport est un graphe utilisé pour suivre l'évolution de l'état acido-basique d'un patient. Il est à citer parmi le diagramme de Van Yperseele[réf. nécessaire][1] mais reste le plus utilisé et le plus simple à comprendre.
Fondements chimiques
Le diagramme de Davenport est fondé sur le tampon bicarbonate de l'organisme. Ce tampon n'est pas unique. Il faudra faire la distinction entre les systèmes tampon ouvert (tampon bicarbonates) — il mérite cette appellation car il possède deux pôles ouverts aux échanges (respiratoire et rénal) — et les autres tampons (phosphates, protéinates, hémoglobine) sont dits fermés car ils ne sont sujets à aucune variation (hors pathologie spécifique). Il faut pour comprendre l'article rappeler l'équation générique de Henderson Hesselbach.
On a donc pH= pKa+ log(HCO3−/CO2). Le schéma de Davenport est basé sur le tampon bicarbonate.
Il est à citer parmi :
- Les tampons phosphates
L'acide phosphorique (H3PO4) est capable de libérer trois protons H+. Autrement dit il peut être sous trois formes.
Pour chaque entité H+ relâchée on va avoir une constante de dissociation Kd. Pour un acide, la constante de dissociation valant le Ka, on peut dire que l'acide phosphorique possède trois pKa. Pour la première fonction acide (on s'intéresse ici au premier H+ que l'acide phosphorique va relâcher) le pKa est de 2,12. Les autres fonctions possèdent un pKa de 7,21 et de 12,67. Le pH physiologique humain est de 7.4. Seule la deuxième fonction acide est concernée. Il suffit pour s'en convaincre d'appliquer la relation d'Henderson-Hesselbach et ceci en prenant un pH de 7.4 pour les calculs.
Ce tampon permet de se défendre contre une agression basique.
- Les protéinates
Nous parlons ici d'anions protéinates car, au pH physiologique de 7,4, les acides aminés sont dissociés de manière à se comporter en base. Ils vont donc constituer une ligne supplémentaire de défense de l'organisme contre une agression acide.
- L'hémoglobine
Constatons la réaction de captation du dioxygène par l'hémoglobine :
HbH + 4O2 ↔ Hb(O2)4- + H+
On constate que le pKa de la désoxyhémoglobine est de 7.8, c'est donc une base faible. Elle pourra donc très bien réagir avec le CO2, acide. C'est un rempart contre une attaque acide.
- Le tampon bicarbonate
Il se base sur la réaction suivante :
Le pKa du couple (HCO3−/CO2) est de 6,1. L'équation d'Henderson-Hesselbach devient :
Fondements physiopathologiques
On distingue deux pôles. On parlera d'un pôle respiratoire car les poumons vont éliminer le CO2 sanguin. Ils permettront de faire diminuer le CO2 et donc, en raisonnant avec l'équation d'Henderson-Hesselbach, de faire augmenter le pH sanguin. Le rein en tant que filtre sanguin va permettre de réabsorber les bicarbonates donc augmenter la concentration sanguine. Toujours en raisonnant avec l'équation d'Henderson-Hesselbach, on constate qu'en faisant augmenter la concentration en bicarbonates on fait augmenter le pH. Ils pourront éliminer des ions H+ et donc faire augmenter le pH. Chaque membre de la réaction chimique illustre les propos précédents
- Pôle respiratoire et pôle métabolique
Le pôle respiratoire tout d'abord permet l'expiration du dioxyde de carbone. On peut résumer le mécanisme de passage de l'O2 dissous à l'O2 gazeux par la loi d'équilibre de Henry. On a donc Où P représente une pression partielle en CO2 et c la concentration dissoute. Les deux grandeurs sont liées par le coefficient thermodynamique a qui a souvent une valeur de 3 *10^-1 pour une pression partielle exprimée en mmHg et donc une concentration en mmol*l^-1. Le pôle métabolique est plus complexe à expliciter. L'acide carbonique est synthétisé par l'anhydrase carbonique. Le rein va fonctionner comme une aide à la dissociation ionique, il va produire le dernier membre de l'équation de la réaction chimique et va donc produire un ion hydrogénocarbonate et oxonium car nous sommes en milieu aqueux. L'ion hydrogénocarbonate sera réinjecté dans l'organisme tandis que le polaron sera éliminé via l'urine. Détaillons ici le mécanisme d'élimination des ions acides il y en a deux principaux à savoir l'utilisation des phosphates ; Le second est plus complexe, les ions ammonium dont le pKa est de 9.3 sont dissociés que très infinitésimalement ils se comportent donc comme des acides très faibles ou avec une constante d'association très forte ce qui en fait des bases modérément fortes. Les ions ammoniums deviennent donc des ions ammoniaques éliminés dans l'urine et de par sa structure moléculaire dans l'urée. Signalons au passage que les ions ammoniums sont fournis par la glutaminase qui détruit l'acide aminé homonyme pour les fournir.
Il existera donc deux types de pathologies correspondant à ces deux pôles. Il faut de suite remarquer que la pathologie métabolique touchera les ions hydrogénocarbonates tandis que la pathologie respiratoire touchera la concentration en CO2 qu'elle soit sous forme gazeuse ou aqueuse(loi de Henry) Reprenons notre équation d'Henderson Hesselbach : Il nous faut exprimer la concentration des ions hydrogénocarbonates pH=pKa +log(HCO3/CO2) d'où l'équivalence 10^(pH-pKa)=HCO3/CO2 et donc HCO3=CO2*10^(pH-pKa) Le diagramme sera formé dans le cas d'une pathologie métabolique par des isobares puissances. Autre cas celui d'une pathologie du pôle respiratoire. Il faut réaliser que le ph varie en fonction de la quantité de base ajoutée c'est-à-dire encore une fois de la concentration en hydrogénocarbonates. Formalisons cette expression ;pH=k*HCO3 Le coefficient directeur de cette droite est où y est la quantité de base ajoutée. Nous avons rencontré ce formalisme dans l'article solution tampon. Il faut dire ici que le pouvoir tampon est noté T et qu'il correspond à dy/dph. On a donc dans cette expression k=1/T. Nous devons ajouter que l'expression devient HCO3=-T*ph+HCO3(t=0) En conclusion, on obtient un graphe avec des isobares de fonctions puissance pour une pathologie métabolique et une fonction linéaire décroissante pour ce qui est de la pathologie respiratoire.
Pathologies
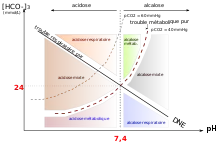
Nous avons de prime abord distingué pathologie métabolique et respiratoire, on évoque un diagramme de régulation acido basique ; il faut donc parler de pathologie évoquant un excès d'acide ou plus rigoureusement un pH général de l'organisme assez faible c'est l'acidose. À l'opposé c'est un pH trop élevé, c'est l'alcalose. Pour comprendre il faut reprendre la réaction de dissolution du dioxyde de carbone
Il nous faut encore dire que toute pathologie métabolique sera compensée par son opposé dans l'équation de dissolution c'est-à-dire par un mécanisme respiratoire. On peut voir l'équation comme possédant deux portes dont une est forcément ouverte alors que l'autre est fermée. Deuxième remarque d'importance : la priorité absolue de l'organisme est de retourner à des valeurs correctes de pH. On comprend pourquoi les ions H+ peuvent créer des liaisons hydrogène perturbatrices, changer l'ionisation des acides aminés et donc par extension des protéines. Dernier exemple l'effet bohr Commençons par l'acidose métabolique, elle peut survenir quand les reins, vecteurs principaux de l'élimination des ions H+, sont moins fonctionnels. Il va y avoir une augmentation de concentration des ions H+ et les ions hydrogénocarbonates se réassocient avec les H+ pour être éliminés en CO2. Ainsi les poumons vont devoir expirer une concentration phénoménale de CO2 dissous. Rappelons la loi de Henry ;c=a*P le coefficient a est de 0.3 pour 1 mmol de CO2 on a 3 mmHg de pression partielle de CO2. C'est cette expression qui explique que le patient aura une hyperpnée ou une polypnée. Cette situation est fréquente dans les pathologies de type diabète où il y a une déficience des reins. Le mécanisme régulateur ici est une alcalose respiratoire, ainsi l'organisme va constater qu'au niveau de ces récepteurs qu'il y a un excès de H+, dans son effort pour éliminer cet excès, il faut pour comprendre imaginer que le stock d'anions hydogénocarbonate est épuisé ainsi la réaction de reformation est arrêtée. Il va donc puiser dans son stock (voir l'ionogramme) pour forcer la transformation chimique.
Deuxième cas le plus souvent rencontré, l'acidose respiratoire. Le mécanisme est aisé à comprendre. Le pôle respiratoire est bloqué, ce qui entraine une dissociation quantifiée par la loi d'action de masse d'acide carbonique et donc une acidification de l'organisme et donc une hausse des bicarbonates. Cette situation est fréquente, ainsi à la suite d'une apnée le sportif sera en nette acidose respiratoire. La régulation fait appel à une alcalose métabolique. Les reins vont donc être fortement sollicités. Revenons à nos isobares de fonctions puissances: HCO3=CO2*10^(pH-pKa) Dans la pathologie d'ordre respiratoire la concentration en CO2 est évidemment augmentée. La concentration évolue dans le même sens que cette dernière. Pour réguler cet excès l'organisme va se mettre à faire fonctionner les reins et donc augmenter l'élimination des cations acides mais aussi provoquer la réabsorption des anions hydrogénocarbonates. Il va donc pour réguler ces paramètres physiologiques se mettre en situation d'alcalose métabolique. Enfin cette situation d'acidose respiratoire est vécue fréquemment par tout un chacun. Elle correspond à une situation de stress.
Pour être tout à fait complet, il faut dire que la précision statistique est de 95 % (selon la loi normale de Laplace Gauss) pour ce diagramme.
Notes et références
- « Les troubles de l’équilibre acido-basique », sur /www.medecine.ups-tlse.fr (consulté le )
Liens externes
- www.humans.be
- Manuel Pratique d'anesthésie sur google books
- un Diagramme interactif de davenport, en téléchargement libre, et opensource
- Portail de la médecine