Dicarbonate de di-tert-butyle
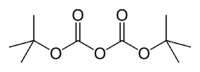
Le dicarbonate de di-tert-butyle est un ester de carbonate de formule semi-développée [(CH3)3COCO]2O. C'est un réactif très utilisé en synthèse organique[5]. Il réagit avec les amines pour donner les dérivés BOC (N-tert-butoxycarbonyle) qui sont des carbamates. Ces dérivés ne se comportant plus comme des amines, permettent de faire certaines réactions qui, autrement, auraient pu affecter la fonction amine. Le groupe protecteur BOC peut être alors retiré de l'amine en utilisant un acide.
| dicarbonate de di-tert-butyle | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | dicarbonate de di-tert-butyle | |
| Synonymes |
pyrocarbonate de di-tert-butyle |
|
| No CAS | ||
| No ECHA | 100.042.021 | |
| No CE | 246-240-1 | |
| No RTECS | HT0230000 | |
| PubChem | 90495 | |
| ChEBI | 48500 | |
| SMILES | ||
| InChI | ||
| Apparence | solide/liquide incolore | |
| Propriétés chimiques | ||
| Formule | C10H18O5 [Isomères] |
|
| Masse molaire[1] | 218,246 9 ± 0,010 8 g/mol C 55,03 %, H 8,31 %, O 36,65 %, |
|
| Propriétés physiques | ||
| T° fusion | 23 °C[2] | |
| T° ébullition | 56-57 °C à 0,5 mmHg[2] | |
| Masse volumique | 0,95 g·cm-3 à 25 °C[2] | |
| T° d'auto-inflammation | 460 °C [3] | |
| Point d’éclair | 37 °C[2] | |
| Propriétés optiques | ||
| Indice de réfraction | = 1,409[2] | |
| Précautions | ||
| SGH[3] | ||
  |
||
| Transport[3] | ||
| Écotoxicologie | ||
| DL50 | < 5 000 mg·kg-1 (mammifère non spécifié, oral)[4] < 2 000 mg·kg-1 (mammifère non spécifié, s.c.)[4] |
|
| CL50 | 100 mg/m3/4H (rat,inhalation)[4] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Synthèse
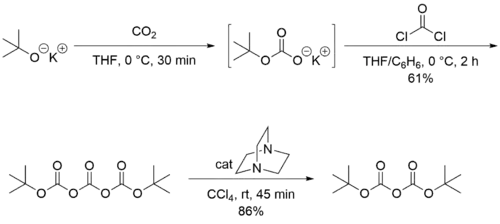
Le dicarbonate de di-tert-butyle est peu coûteux de sorte qu'il est habituellement acheté. Classiquement, ce composé est préparé à partir de tert-butanol, de dioxyde de carbone et de phosgène, en utilisant comme base le DABCO[6] :
Cette voie est actuellement utilisée dans le commerce par les fabricants de Chine et d'Inde. Les entreprises européennes et japonaises utilisent la réaction du tert-butylate de sodium avec du dioxyde de carbone, catalysée par l'acide p-toluènesulfonique ou par l'acide méthanesulfonique. Ce processus implique une distillation du produit brut, qui donne un produit final de très bonne pureté.
L'anhydride de Boc est également disponible en solution à 70 % dans le toluène ou le THF, etc. En effet, comme il a un point de fusion bas (23 °C), disposer de ce réactif sous la forme d'un liquide simplifie son stockage et sa manutention.
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Di-tert-butyl dicarbonate » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Di-tert-butyl dicarbonate chez Sigma-Aldrich
- Entrée « Di-tert-butyldicarbonate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 octobre 2010 (JavaScript nécessaire)
- Bis(tert-butoxycarbonyl)oxide sur ChemIDPlus.
- Wakselman, M. “Di-t-butyl Dicarbonate” in Encyclopedia of Reagents for Organic Synthesis (Ed: L. Paquette) 2004, J. Wiley & Sons, New York. DOI:10.1002/047084289.
- Barry M. Pope, Yutaka Yamamoto, and D. Stanley Tarbell, Dicarbonic acid, bis(1,1-dimethylethyl) ester, Org. Synth., coll. « vol. 6 », , p. 418
- Portail de la chimie