Diimide
Le diimide, est un composé inorganique de formule HN=NH. Les composés azo peuvent être considérés comme dérivés de ce composé par substitution des atomes d'hydrogène par des groupes organiques. Comme chaque atome d'azote porte un atome d'hydrogène, un doublet libre, et est lié à l'autre par une double liaison qui empêche la libre rotation d'axe N-N, le diimide existe en deux isomères, cis et trans.
Pour les articles homonymes, voir H2N2.
| Diimide | |
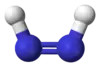 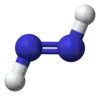 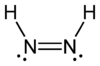 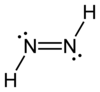 Représentations 2D et 3D des isomères cis et trans du diimide |
|
| Identification | |
|---|---|
| Synonymes |
Diazène |
| No CAS | (E) (Z) |
| PubChem | |
| SMILES | |
| Propriétés chimiques | |
| Formule | H2N2 [Isomères] |
| Masse molaire[1] | 30,029 3 ± 0,000 5 g/mol H 6,71 %, N 93,29 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Histoire
Le diimide a été isolé pour la première fois par le chimiste allemand Nils Wiberg en 1972.
Utilisations
Hydrogénation
Le cis-diazène est un composé utile en synthèse organique ; il peut être utilisé pour hydrogéner un alcène ou un alcyne (et donc les réduire en alcane), avec une stéréosélectivité du côté où les hydrogènes viennent s'additionner. Le résultat est le même type de stéréosélectivité que dans le cas d'une addition syn de dihydrogène, catalysée par un métal (hydrogénation catalytique). Les avantages d'une telle méthode de synthèse sont :
- pas de dihydrogène à pression élevée (avec des risques potentiels d'explosion );
- gaz relâchés inertes (principalement du diazote) ;
- pas d'utilisation de métaux coûteux (nickel de Raney, palladium, platine,…) pour catalyser la réaction.
Mécanisme réactionnel
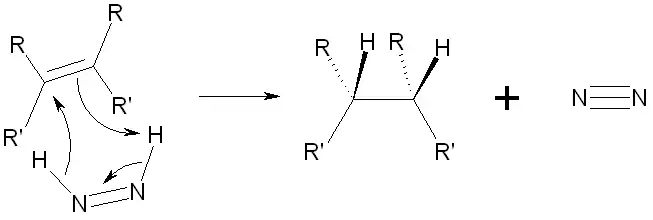
Bibliographie
- Wiberg, E.; Holleman, A. F., Inorganic Chemistry, Elsevier, (ISBN 0-12-352651-5, lire en ligne), « 1.2.7: Diimine, N », p. 628
- Miller, Charles E. Hydrogenation with diimide. Journal of Chemical Education (1965), 42(5), 254-9. CODEN: JCEDA8 (ISSN 0021-9584).
- Trost et al Journal of the American Chemical Society 127 11 2005 3667 DOI:10.1021/ja042435i
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Diazene » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Portail de la chimie