Etonogestrel
L'étonogestrel est un médicament couramment utilisé comme moyen de contraception féminine[1],[2],[3],[4]. Il est disponible sous la forme d'un implant placé sous la peau de la partie supérieure du bras, sous les noms de marque Nexplanon et Implanon, et en association avec l'éthinylestradiol, un œstrogène, sous forme d'anneau vaginal sous les noms de marque NuvaRing et Circlet[5]. L'étonogestrel en implant est efficace comme contraceptif dans les 8 heures après insertion[6] pour au moins trois ou quatre ans, certaines données montrant une efficacité pendant cinq ans[7]. Après le retrait, la fertilité revient rapidement[8].
| Etonogestrel | |
| |
| Données pharmacocinétiques | |
|---|---|
| Excrétion | |
| Identification | |
| No CAS | |
| No ECHA | 100.053.561 |
| Code ATC | G03AC08 |
| DrugBank | 00294 |
Les effets secondaires de l'étonogestrel comprennent les irrégularités menstruelles, la sensibilité des seins, les changements d'humeur, l'acné, les maux de tête, la vaginite…[1]. C'est un progestatif de synthèse, qui fonctionne comme agoniste du récepteur de la progestérone[9]. Il agit en bloquant l'ovulation, en épaississant le mucus autour de l'ouverture du col de l' utérus et en modifiant la muqueuse de l'utérus[10].
Il a une activité androgénique et glucocorticoïde très faible, on ne lui connait aucune autre activité hormonale importante[9].
L'étonogestrel a été breveté en 1972 et introduit pour un usage médical en 1998[11],[12],[13]. Il est devenu disponible aux États-Unis en 2006[11],[12]. Les implants d'étonogestrel sont approuvés dans plus de 90 pays et utilisés par environ trois millions de femmes dans le monde en 2010[10],[14].
Un progestatif étroitement apparenté, plus connu et plus utilisé est le désogestrel, un promédicament précurseur de l'étonogestrel dans le corps[9].
Utilisations médicales
L'étonogestrel est utilisé dans la contraception hormonale sous la forme de l'implant contraceptif étonogestrel[1]> et de l'anneau vaginal contraceptif dans ce dernier cas en association avec l'éthinylestradiol (noms de marque NuvaRing, Circlet)[2].
Les implants contraceptifs à l'étonogestrel sont de type réversible et à longue durée d'action, ils se sont avéré compter parmi les contraceptifs les plus efficaces[15]. Le taux d'échec des implants est de 0,05 % pour une utilisation parfaite et une utilisation typique car la méthode ne nécessite aucune action de l'utilisateur après la pose[16].
Des études basées sur plus de 2 467 femmes-années d'exposition, n'ont trouvé aucun cas de grossesse[17],[18],[19].
D'autres études ont, elles, trouvé des échecs, attribués à des échecs de la méthode elle-même et/ou à un mauvais placement, à des interactions médicamenteuses ou à une conception avant l'insertion de l'implant ou de l'anneau[20].
En comparaison, la stérilisation tubaire a un taux d'échec de 0,5 % et les DIU ont un taux d'échec de 0,2 à 0,8 %[16]. Un seul implant est approuvé pour trois ans avec des données montrant une efficacité pendant cinq ans[21],[7].
Contre-indications
Les femmes ne devraient pas utiliser d'implants si elles[22] :
- sont ou pensent être enceinte
- sont allergiques à l'étonogestrel
- ont des saignements vaginaux n'ayant pas été expliqués
- ont certaines formes de maladie hépatique grave
Elles ne doivent pas utiliser de contraceptifs hormonaux combinés (CHC) si elles ont des migraines avec auras[23].
Une liste complète des contre-indications peut être trouvée dans les Critères d'éligibilité médicale de l'OMS pour l'utilisation de la contraception 2015 et les Critères d'éligibilité médicale du CDC aux États-Unis pour l'utilisation de la contraception 2016.
Effets secondaires
Saignements irréguliers et saignotements : De nombreuses femmes connaîtront un certain type de saignements irréguliers, imprévisibles, prolongés, fréquents ou peu fréquents[24]. Certaines femmes souffrent également d'aménorrhée. Chez certaines femmes, les saignements prolongés diminueront après les trois premiers mois d'utilisation. Mais d'autres pourront voir ce schéma de saignement se prolonger jusqu'à cinq années d'utilisation.
Bien que ces saignements ne soient pas dangereux, ils sont la raison la plus courante invoquée pour interrompre l'utilisation de l'implant. Après le retrait, les périodes de saignement reviennent au rythme antérieur chez la plupart des femmes[17],[18],[19].
Complications d'insertion : Certains effets secondaires mineurs tels que des ecchymoses, une irritation de la peau ou des douleurs autour du site d'insertion sont courants[17]. Des complications (rares) peuvent survenir (ex. : infection ou expulsion[17],[25]. Parfois, une complication grave survient quand le prestataire ne parvient pas à correctement insérer l'implant (une étude australienne a rapporté 84 grossesses à la suite d'un tel échec)[20].
Migration : Très rarement, le bâtonnet peut se déplacer légèrement à l'intérieur du bras, ce qui peut rendre le retrait plus difficile. Il est possible que l'insertion dans le même site qu'un implant précédent augmente la probabilité de migration[25]. Le bâtonnets implanté ne peut être localisés que par ultrasons à haute fréquence ou imagerie par résonance magnétique (IRM)[17]. Il peut être localisé à l'aide de rayons X ou de tomodensitométrie traditionnels quand il contient du sulfate de baryum. De rares cas d'implants ayant atteint le poumon via l'artère pulmonaire ont été signalés[26]. Une insertion sous-cutanée correcte sur le muscle triceps réduit le risque de tels événements.
Prise de poids possible : Certaines femmes peuvent légèrement prendre du poids lors de l'utilisation de l'implant[17] mais les études disponibles ne sont pas concluantes car ne comparant pas le poids des femmes utilisant des implants avec un groupe témoin de femmes n'en utilisant pas. L'augmentation moyenne du poids corporel dans les études était inférieure à 2,25 kg (5 livres) sur 2 ans[18].
Kystes ovariens : Une petite partie des femmes utilisant des implants et d'autres implants contraceptifs développent des kystes ovariens[17]. Ces kystes disparaissent habituellement sans traitement[27].
Grossesse : il est recommandé de retirer les implants en cas de grossesse. Cependant, il n'y a aucune preuve suggérant que l'implant ait un effet négatif sur la grossesse ou le développement du fœtus[17].
Acné : L'acné a été auto-déclarée comme un effet secondaire et est répertoriée comme un effet secondaire par la FDA. Mais une étude d'utilisateurs a révélé qu'une majorité d'utilisateurs souffrant d'acné avant leur insertion ont signalé que leur acné avait diminué, et seulement 16 % de ceux qui n'avaient pas d'acné avant l'insertion en ont développé[18].
Autres symptômes possibles : D'autres symptômes ont été signalés lors d'essais d'implants : maux de tête, labilité émotionnelle, douleurs abdominales, perte de libido et sécheresse vaginale[17], mais aucune étude n'a déterminé de manière concluante que ces symptômes sont causés par l'implant[18],[19].
Surdosage
Aucun effet secondaire grave n'est attendu en cas de surdosage de contraceptifs en général[28].
Interactions
L'éfavirenz, un inducteur de l'enzyme hépatique CYP3A4, semble diminuer les taux d'étonogestrel[29] et augmenter les taux de grossesses non désirées chez les utilisatrices d'implants.
Des effets similaires sont attendus pour d'autres inducteurs du CYP3A4, mais on ne sait pas s'ils sont cliniquement pertinents. L'inverse est vrai des inhibiteurs du CYP3A4 tels que le kétoconazole, l'itraconazole et la clarithromycine : ils pourraient augmenter les concentrations d'étonogestrel dans l'organisme[28].
Forme implant

Nexplanon/Implanon se compose d'une tige de 4 cm de long et 2 mm de diamètre, faite d'un copolymère d'éthylène et d'acétate de vinyle[24] (taille d'une allumette). L'implant contient 68 mg d'étonogestrel (parfois appelé 3-céto-destrogestrel), un type de progestatif[17]. Les concentrations sériques maximales d'étonogestrel atteignent 781–894 pg/mL au cours des premières semaines, diminuant progressivement jusqu'à 192–261 pg/mL après un an, 154–194 pg/mL après deux ans et 156–177 pg/mL après trois ans, maintenant la suppression de l'ovulation et l'efficacité contraceptive[30]. Les taux sériques restent relativement stables pendant 36 mois, ce qui implique que la méthode peut être efficace pendant plus de trois ans[31].
Bien que ceci n'ait pas été officiellement reconnu par le fabricant, des études ont montré qu'il reste un contraceptif très efficace pendant cinq années[21].
Il s'agit d'un type de contraception progestative seule.
Insertion et retrait
Un clinicien expérimenté doit effectuer l'insertion des implants pour assurer une insertion correcte et minimiser le risque de lésions nerveuses ou de mauvais placement, ce qui pourrait entraîner une grossesse[32]. Avant l'insertion, le bras est lavé avec une solution de nettoyage et un anesthésique local est appliqué sur la partie supérieure du bras autour de la zone d'insertion[17]. Un applicateur en forme d'aiguille est utilisé pour insérer la tige sous la peau dans le tissu sous-cutané de la face interne du bras en arrière de la rainure entre les muscles biceps et triceps[33]. Le temps moyen d'insertion est de 0,5 à 1 minute[18],[19]. Un pansement doit ensuite être conservé sur le site d'insertion durant 24 heures. Des ecchymoses et un léger inconfort sont fréquents après l'insertion[17]. Des complications graves au site d'insertion (infection…) peuvent survenir, mais très rarement (chez moins de 1 % des patientes). Si une femme reçoit un implant en dehors des cinq premiers jours de ses règles, elle doit attendre avant d'avoir des rapports sexuels ou utiliser une méthode de contraception d'appoint (comme un préservatif, un préservatif féminin, un diaphragme, une éponge ou une contraception d'urgence ) pendant la semaine suivante après insertion pour prévenir la grossesse. Cependant, si l'implant est inséré pendant les cinq premiers jours de la période d'une femme, elle est protégée pour ce cycle et au-delà[34].
Les implants peuvent être retirés (toujours par un clinicien expérimenté) à tout moment si une grossesse est souhaité. Lors du retrait, un anesthésique local est à nouveau utilisé autour de la zone de l'implant à l'extrémité distale[17]. Si l'opérateur ne peut sentir l'implant, l'imagerie médicale peut être nécessaires pour localiser la tige avant de pouvoir la retirer. Une petite incision est pratiquée dans la peau à l'extrémité du site de l'implant. Dans certains cas, une gaine fibreuse peut s'être formée autour de l'implant, auquel cas cette gaine doit être incisée[17]. L'implant est retiré à l'aide d'une pince. La procédure de retrait dure en moyenne 3 à 3,5 minutes[18],[19].
Fertilité après retrait
Dans la semaine suivant le retrait, les hormones qui avaient été délivrées par l'appareil quittent le corps et l'étonogestrel est indétectable chez la plupart des utilisatrice[17]. La plupart des femmes (re) commenceront à ovuler dans les six semaines suivant le retrait[31],[35]. Les niveaux de fertilité reviendront à ce qu'ils étaient avant l'insertion de l'implant[8].
Différences
Nexplanon et Implanon NXT sont essentiellement identiques à Implanon sauf que Nexplanon et Implanon NXT ont 15 mg de sulfate de baryum ajouté au noyau, ce qui le rend détectable par les rayons X[36],[21]. Nexplanon et Implanon NXT ont également un applicateur préchargé pour une insertion plus facile[37].
Pharmacologie
Le mécanisme d'action des contraceptifs progestatifs seuls dépend de l'activité et de la dose du progestatif[38]. Les contraceptifs progestatifs à dose intermédiaire comme Nexplanon ou Implanon permettent un certain développement folliculaire mais inhibent l'ovulation dans presque tous les cycles comme principal mécanisme d'action. L'ovulation n'a pas été observée dans les études sur Implanon au cours des deux premières années d'utilisation et seulement rarement au cours de la troisième année sans grossesse. Un mécanisme d'action secondaire est l'augmentation progestative de la viscosité de la glaire cervicale qui inhibe la pénétration des spermatozoïdes[39].
Les contraceptifs hormonaux ont également des effets sur l'endomètre, qui pourraient théoriquement affecter l'implantation, mais aucune preuve scientifique n'indique que la prévention de l'implantation résulte réellement de cet effet[40].
Pharmacodynamie
L'étonogestrel est un progestatif ou un agoniste du récepteur de la progestérone[9]. Il est moins androgène que le lévonorgestrel et la noréthistérone[41],[42] et il ne provoque pas de diminution des taux de globuline liant les hormones sexuelles[43]. Cependant, il est toujours associé à l'acné chez jusqu'à 13,5 % des patients lorsqu'il est utilisé comme implant, bien que cet effet secondaire ne représente que 1,3 % des retraits prématurés de l'implant[6]. En plus de son activité progestative et androgénique faible, l'étonogestrel se lie au récepteur des glucocorticoïdes avec environ 14 % de l'affinité de la dexaméthasone (contre 1 % pour le lévonorgestrel) et a une très faible activité glucocorticoïde[9]. L'étonogestrel n'a pas d'autre activité hormonale (par exemple, œstrogénique, antiminéralocorticoïde )[9]. Une certaine inhibition de la 5α-réductase et des enzymes du cytochrome hépatique P450 a été observée avec l'étonogestrel in vitro, comme avec d'autres progestatifs de la 19-nortestostérone[9].
| Composé | PR | AR | ER | GR | MR | SHBG | CBG |
|---|---|---|---|---|---|---|---|
| Étonogestrel | 150 | 20 | 0 | 14 | 0 | 15 | 0 |
| 5α-dihydroétonogestrel | 9 | 17 | 0 | ? | ? | ? | ? |
| Sources : Les valeurs sont des pourcentages (%). Les ligands de référence (100 %) étaient la prome-gestone pour le PR, la métribolone pour l'AR, l'{{,}}<abbr about="#mwt524" data-cx="[{"adapted":true,"partial":false,"targetExists":true}]" data-mw="{"parts":[{"template":{"target":{"wt":"Abréviation","href":"./Modèle:Abréviation"},"params":{"1":{"wt":"E2"},"2":{"wt":"estradiol"}},"i":0}}]}" data-ve-no-generated-contents="true" id="mwAc0" title="estradiol" typeof="mw:Transclusion mw:ExpandedAttrs">E2</abbr>{{,}} pour l'ER, la DEXA pour le GR, l'aldostérone pour le MR, la DHT pour la SHBG et le cortisol pour le CBG . Source[44],[9]. | |||||||
Pharmacocinétique
La biodisponibilité de l'étonogestrel lorsqu'il est administré sous forme d'implant sous-cutané ou d'anneau vaginal est de 100 %[1],[2]. Les taux d'étonogestrel à l'état d'équilibre sont atteints en une semaine après l'insertion sous forme d'implant ou d'anneau vaginal[1],[2]. Le volume de distribution moyen de l'étonogestrel est de 201 L.[1]. La liaison aux protéines plasmatiques du médicament est d'au moins 98 %, dont 66 % sont liés à l'albumine et 32 % sont liés à la globuline liant les hormones sexuelles[1],[2]. L'étonogestrel est métabolisé dans le foie par le CYP3A4[1],[2]. L'activité biologique de ses métabolites est inconnue[1],[2]. La demi-vie d'élimination de l'étonogestrel est d'environ 25 à 29 les heures[1],[2]. Après le retrait d'un implant contenant de l'étonogestrel, les niveaux du médicament étaient inférieurs aux limites de détection du test d'une semaine[1]. La majeure partie de l'étonogestrel est éliminée dans les urines et une petite partie est éliminée dans les fèces[1],[2].
Chimie
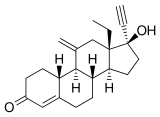
L'étonogestrel, également appelé 11-méthylène-17α-éthynyl-18-méthyl-19-nortestostérone ou 11-méthylène-17α-éthynyl-18-méthylestr-4-ène-17β-ol-3-one, est un estrane synthétique stéroïde et un dérivé de la testostérone[3],[5]. Il s'agit plus spécifiquement d'un dérivé de la noréthistérone (17α-éthynyl-19-nortestostérone) et fait partie du sous-groupe des gonanes (18-méthylestrane) de la famille des progestatifs 19-nortestostérone[45],[46]. L'étonogestrel est le dérivé cétone C3 du désogestrel et le dérivé méthylène C11 du lévonorgestrel et est également connu sous le nom de 3-cétodésogestrel et de 11-méthylènelévonorgestrel.
Histoire
La possibilité de créer un 'implant contraceptif sous-cutané a commencé lorsque le silicone a été découvert dans les années 1940 et après qu'il se soit avéré biocompatible avec le corps humain[47]. En 1964, Folkman et Long ont publié la première étude démontrant qu'une telle tige pouvait être utilisée pour administrer des médicaments[48]. En 1966, Dziuk et Cook ont publié une étude qui examinait les taux de libération et suggérait que les bâtonnets pourraient bien convenir à la contraception[49]. Après une étude ayant utilisé des implants contenant des progestatifs pour la contraception, le Population Council a développé et breveté Norplant et Jadelle[50]. Norplant a six bâtonnets et est considéré comme un implant de première génération. Jadelle (Norplant II), un implant à deux tiges, et d'autres implants à tige unique qui ont suivi, ont été développés en raison de complications résultant du système à 6 tiges de Norplant. Le système Jadelle contient deux bâtonnets de silicone mélangés à du lévonorgestrel. En 1990, De Nijs a breveté une technique d'extrusion coaxiale de copolymères d'éthylène vinylacétate et de 3-céto-désogestrel (étonogestrel) pour la préparation de dispositifs contraceptifs à longue durée d'action, tels que Implanon, Nexplanon et Nuvaring[51]. Les bâtonnets simples étaient moins visibles sous la peau et ils utilisaient de l'étonogestrel plutôt que du lévonorgestrel (dans l'espoir d'une réduction des effets secondaires)[47].
Le désogestrel (3-décétoétonogestrel), un promédicament de l'étonogestrel, a été introduit à des fins médicales en 1981[52],[53].
Norplant a été utilisé dans un nombre croissant de pays à partir de 1983 ; commercialisé aux États-Unis et au Royaume-Uni en 1993. En raison de nombreuses complications lors du retrait du Norplant aux États-Unis, il a été retiré du marché en 2002. Bien que Jadelle ait été approuvée par la FDA, elle n'a jamais été commercialisée aux États-Unis, mais elle est largement utilisée en Afrique et en Asie[50].
L'étonogestrel lui-même a été introduit pour la première fois sous le nom d'Implanon en Indonésie en 1998[11],[12] ; il a été commercialisé au Royaume-Uni peu après[54] et approuvé pour une utilisation aux États-Unis en 2006[11],[12]. Nexplanon a été développé pour éliminer le problème de non-insertion et de localisation d'Implanon en changeant le dispositif d'insertion et en rendant la tige radio-opaque[36]. Depuis janvier 2012, Implanon n'est plus commercialisé et Nexplanon est le seul implant monotige disponible.
Société et culture
Noms génériques
L'étonogestrel est le nom générique du médicament et ses INN, USAN et BAN[3],[5].
Il est aussi connu sous son nom de code de développement ORG-3236[3],[5].
Noms de marques
L'étonogestrel est commercialisé sous les noms de marque Circlet, Implanon, Nexplanon et NuvaRing[3],[5].
Disponibilité
L'étonogestrel est largement disponible dans le monde, dont aux États-Unis, au Canada, au Royaume-Uni, en Irlande, ailleurs en Europe, en Afrique du Sud, en Amérique latine, en Asie du Sud, de l'Est et du Sud-Est, et ailleurs dans le monde[5].
Recherche
Un dispositif intra-utérin libérant de l'étonogestrel était en cours de développement pour être utilisé comme forme de contraception chez les femmes, mais son développement a été interrompu en 2015[55].
L'étonogestrel a été étudié pour être utilisé comme contraceptif masculin potentiel[56].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Etonogestrel » (voir la liste des auteurs).
- (en) « Nexplanon-etonogestrel implant », DailyMed, (consulté le ).
- « NuvaRing- etonogestrel and ethinyl estradiol insert, extended release », DailyMed, (consulté le )
- Index Nominum 2000: International Drug Directory, Taylor & Francis, , 420 p. (ISBN 978-3-88763-075-1, lire en ligne)
- Thomas L. Lemke et David A. Williams, Foye's Principles of Medicinal Chemistry, Lippincott Williams & Wilkins, , 1409– (ISBN 978-1-60913-345-0, lire en ligne)
- « Etonogestrel »
- Gretchen M Lentz, Rogerio A. Lobo, David M Gershenson et Vern L. Katz, Comprehensive Gynecology, Elsevier Health Sciences, , 256– (ISBN 978-0-323-09131-2, lire en ligne)
- (en) Pamela S. Lotke, Contraception, An Issue of Obstetrics and Gynecology Clinics, E-Book, Elsevier Health Sciences, (ISBN 9780323402590, lire en ligne), p. 634
- The selection and use of essential medicines. Twentieth report of the WHO Expert Committee 2015 (including 19th WHO Model List of Essential Medicines and 5th WHO Model List of Essential Medicines for Children), Geneva, World Health Organization, , 332–36 p. (ISBN 9789241209946, ISSN 0512-3054, hdl 10665/189763).
- « Pharmacology of estrogens and progestogens: influence of different routes of administration », Climacteric, vol. 8 Suppl 1, , p. 3–63 (PMID 16112947, DOI 10.1080/13697130500148875, lire en ligne)
- Richard Pattman, Nathan Sankar, Pauline Handy et David Ashley Price, Oxford Handbook of Genitourinary Medicine, HIV, and Sexual Health, OUP Oxford, (ISBN 9780199571666, lire en ligne), p. 368
- Helen Carcio et R. Mimi Secor, Advanced Health Assessment of Women, Third Edition: Clinical Skills and Procedures, Springer Publishing Company, , 411– (ISBN 978-0-8261-2308-4, lire en ligne)
- E. J. Mayeaux, The Essential Guide to Primary Care Procedures, Lippincott Williams & Wilkins, , 589– (ISBN 978-1-4511-5286-9, lire en ligne)
- (en) Jnos Fischer et C. Robin Ganellin, Analogue-based Drug Discovery, John Wiley & Sons, (ISBN 9783527607495, lire en ligne), p. 480
- Pramilla Senanayake et Malcolm Potts, Atlas of Contraception, Second Edition, 2, (ISBN 9780203347324, lire en ligne), p. 53
- « Effectiveness of long-acting reversible contraception », The New England Journal of Medicine, vol. 366, no 21, , p. 1998–2007 (PMID 22621627, DOI 10.1056/nejmoa1110855, lire en ligne)
- Guttmacher, « Contraceptive Use in the United States » [archive du ],
- Contraceptive technology, New York, Ardent Media, , 144–156 p., « Contraceptive Implants »
- « Safety and efficacy of Implanon, a single-rod implantable contraceptive containing etonogestrel », Contraception, vol. 71, no 5, , p. 319–26 (PMID 15854630, DOI 10.1016/j.contraception.2004.11.007)
- « Clinical experience and acceptability of the etonogestrel subdermal contraceptive implant », International Journal of Gynaecology and Obstetrics, vol. 90, no 3, , p. 228–33 (PMID 16043175, DOI 10.1016/j.ijgo.2005.06.007)
- « Unintended pregnancies with the etonogestrel implant (Implanon): a case series from postmarketing experience in Australia », Contraception, vol. 71, no 4, , p. 306–8 (PMID 15792651, DOI 10.1016/j.contraception.2004.10.005)
- Robert Anthony Hatcher, Contraceptive technology, New York, NY, 21st, , Chapter 4, specifically pages 129–134 (ISBN 978-1732055605, OCLC 1048947218)
- « US CDC Medical Eligibility Criteria for Contraceptive Use »,
- Nappi, Merki-Feld, Terreno et Pellegrinelli, « Hormonal contraception in women with migraine: is progestogen-only contraception a better choice? », The Journal of Headache and Pain, vol. 14, no 1, , p. 66 (PMID 24456509, PMCID 3735427, DOI 10.1186/1129-2377-14-66)
- « Implanon: a review of the literature with recommendations for clinical management », Journal of Midwifery & Women's Health, vol. 54, no 2, , p. 142–9 (PMID 19249660, DOI 10.1016/j.jmwh.2008.09.004).
- « An assessment of the use of Implanon in three community services », The Journal of Family Planning and Reproductive Health Care, vol. 28, no 4, , p. 193–6 (PMID 12419059, DOI 10.1783/147118902101196540)
- « Nexplanon (etonogestrel) contraceptive implants: Reports of device in vasculature and lung » [archive du ] (consulté le )
- « Nonmenstrual adverse events during use of implantable contraceptives for women: data from clinical trials », Contraception, vol. 65, no 1, , p. 63–74 (PMID 11861056, DOI 10.1016/s0010-7824(01)00289-x)
- (de) Austria-Codex, Vienna, Österreichischer Apothekerverlag,
- Vieira, Bahamondes, de Souza et Brito, « Effect of antiretroviral therapy including lopinavir/ritonavir or efavirenz on etonogestrel-releasing implant pharmacokinetics in HIV-positive women », Journal of Acquired Immune Deficiency Syndromes, vol. 66, no 4, , p. 378–385 (ISSN 1944-7884, PMID 24798768, DOI 10.1097/QAI.0000000000000189)
- « Implanon label » [archive du ] [PDF], FDA, (consulté le )
- « Ovarian function during the use of a single contraceptive implant: Implanon compared with Norplant », Fertility and Sterility, vol. 69, no 4, , p. 714–21 (PMID 9548163, DOI 10.1016/s0015-0282(98)00015-6)
- « Nerve injury caused by removal of an implantable hormonal contraceptive », American Journal of Obstetrics and Gynecology, vol. 195, no 1, , p. 323–6 (PMID 16813761, DOI 10.1016/j.ajog.2005.09.016)
- « Nexplanon Prescribing Information » [PDF] (consulté le )
- Bedsider (2010).
- « Release characteristics, ovarian activity and menstrual bleeding pattern with a single contraceptive implant releasing 3-ketodesogestrel », Contraception, vol. 47, no 3, , p. 251–61. (PMID 8462316, DOI 10.1016/0010-7824(93)90042-6)
- (en) « Nexplanon: what Implanon did next », The Journal of Family Planning and Reproductive Health Care, vol. 36, no 4, , p. 187–9. (PMID 21067632, DOI 10.1783/147118910793048629)
- (en) « RPT-UPDATE 1-Contraceptive alert after women fall pregnant », Reuters, (lire en ligne, consulté le )
- Anna Glasier, Endocrinology, Philadelphia, Elsevier Saunders, , 3000–1 (ISBN 978-0-7216-0376-6), « Contraception »
- Organon, « Implanon SPC (Summary of Product Characteristics) » [archive du ], (consulté le ).
- « The mechanism of action of hormonal contraceptives and intrauterine contraceptive devices », American Journal of Obstetrics and Gynecology, vol. 181, no 5 Pt 1, , p. 1263–9 (PMID 10561657, DOI 10.1016/S0002-9378(99)70120-1)
- F. William Danby, Acne: Causes and Practical Management, John Wiley & Sons, , 77– (ISBN 978-1-118-23277-4, lire en ligne)
- David E. Golan, Principles of Pharmacology: The Pathophysiologic Basis of Drug Therapy, Lippincott Williams & Wilkins, , 521– (ISBN 978-0-7817-8355-2, lire en ligne)
- Leon Speroff et Philip D. Darney, A Clinical Guide for Contraception, Lippincott Williams & Wilkins, , 365– (ISBN 978-1-60831-610-6, lire en ligne)
- « Pharmacokinetics of oestrogens and progestogens », Maturitas, vol. 12, no 3, , p. 171–97 (PMID 2170822, DOI 10.1016/0378-5122(90)90003-o)
- Mary C. Brucker et Tekoa L. King, Pharmacology for Women's Health, Jones & Bartlett Publishers, , 368– (ISBN 978-1-284-05748-5, lire en ligne)
- Donna Shoupe, The Handbook of Contraception: A Guide for Practical Management, Springer Science & Business Media, , 16– (ISBN 978-1-59745-150-5, lire en ligne).
- « Contraceptive implants », African Journal of Reproductive Health, vol. 9, no 1, , p. 16–23 (PMID 16104651, DOI 10.2307/3583156, JSTOR 3583156)
- « The use of silicone rubber as a carrier for prolonged drug therapy », The Journal of Surgical Research, vol. 4, no 3, , p. 139–42 (PMID 14130164, DOI 10.1016/s0022-4804(64)80040-8)
- « Passage of steroids through silicone rubber », Endocrinology, vol. 78, no 1, , p. 208–11 (PMID 5948426, DOI 10.1210/endo-78-1-208)
- Association of Reproductive Health Professionals, « The Single-Rod Contraceptive Implant » [archive du ],
- , "Contraceptive Implant"
- Benno Clemens Runnebaum, Thomas Rabe et Ludwig Kiesel, Female Contraception: Update and Trends, Springer Science & Business Media, , 156–163 p. (ISBN 978-3-642-73790-9, lire en ligne)
- Jeremy A. Holtsclaw, Progress Towards the Total Synthesis of Desogestrel and the Development of a New Chiral Dihydroimidazol-2-ylidene Ligand, University of Michigan., (lire en ligne), p. 25 :
« In 1981, desogestrel was marketed as a new low dose oral contraceptive under the trade names Marvelon and Desogen.32 »
- Anna Glasier et Beverly Winikoff, Contraception, Health Press, (ISBN 978-1-899541-18-8, lire en ligne), p. 41
- « Etonogestrel-releasing intrauterine system - Merck & Co. - AdisInsight »
- « Clinical trials in male hormonal contraception », Contraception, vol. 82, no 5, , p. 457–70 (PMID 20933120, DOI 10.1016/j.contraception.2010.03.020, lire en ligne)
Voir aussi
Bibliographie
- « The pharmacokinetics and pharmacodynamics of Implanon, a single-rod etonogestrel contraceptive implant », Eur J Contracept Reprod Health Care, vol. 5 Suppl 2, , p. 12–20 (PMID 11246602).
- « Endometrial effects of etonogestrel (Implanon) contraceptive implant », Curr. Opin. Obstet. Gynecol., vol. 13, no 3, , p. 335–41 (PMID 11396660, DOI 10.1097/00001703-200106000-00015).
- « Etonogestrel implant (Implanon) for contraception », Drug Ther Bull, vol. 39, no 8, , p. 57–9 (PMID 11526801).
- « Medical eligibility criteria for new contraceptive methods: combined hormonal patch, combined hormonal vaginal ring and the etonogestrel implant », Contraception, vol. 73, no 2, , p. 134–44 (PMID 16413844, DOI 10.1016/j.contraception.2005.08.002).
- « The combined etonogestrel/ethinyl estradiol contraceptive vaginal ring », Expert Opin Pharmacother, vol. 8, no 11, , p. 1769–77 (PMID 17685892, DOI 10.1517/14656566.8.11.1769).
- « The management of unacceptable bleeding patterns in etonogestrel-releasing contraceptive implant users », Contraception, vol. 83, no 3, , p. 202–10 (PMID 21310280, DOI 10.1016/j.contraception.2010.08.001).
- « In brief: etonogestrel (nexplanon) contraceptive implant », Med Lett Drugs Ther, vol. 54, no 1383, , p. 12 (PMID 22354222).
- « Association of Etonogestrel-Releasing Contraceptive Implant with Reduced Weight Gain in an Exclusively Breastfed Infant: Report and Literature Review », Breastfeed Med, vol. 11, no 4, , p. 203–6 (PMID 27032034, PMCID 4860664, DOI 10.1089/bfm.2016.0017).
- « Efficacy and side-effects profile of the ethinylestradiol and etonogestrel contraceptive vaginal ring: a systematic review and meta-analysis », Eur J Contracept Reprod Health Care, vol. 22, no 2, , p. 131–146 (PMID 28256919, DOI 10.1080/13625187.2017.1287351).
Liens externes
- Ressources relatives à la santé :
- Implant d'étonogestrel - AdisInsight
- Anneau vaginal éthinylestradiol/étonogestrel - AdisInsight
- Portail de la pharmacie