Expression des gènes
L'expression des gènes est le mécanisme qui regroupe tous les processus permettant d'aboutir à un produit fonctionnel du gène.
Les mécanismes d'expression
La transcription
La transcription est le processus permettant d'obtenir un brin d'ARN à partir d'un brin d'ADN. Ce mécanisme fait intervenir plusieurs protéines, qui vont venir ouvrir les brins d'ADN complémentaires. Une fois que cela est fait, l'ARN polymérase vient synthétiser un brin d'ARN complémentaire au brin d'ADN matrice. Le brin d'ARN synthétisé, il peut se retirer et laisser les brins d'ADN se rattacher ensemble par l'intermédiaire de protéines.
Cependant, le brin d'ARN obtenu n'est pas mature, dans la mesure où le gène contient des parties codantes, les exons, mais aussi des parties non codantes, les introns. Ces introns ne sont pas nécessaires afin d'obtenir un produit fonctionnel du gène. Il faut donc les retirer. Ce processus, appelé épissage, permet de cliver l'ARN de façon à supprimer les introns, et à coller côte à côte les exons. De cette façon, le brin d'ARN ne contient que les parties codantes du gène. Il reste encore deux étapes afin que le brin d'ARN soit mature.
L'ARN est d'abord modifié à son extrémité 5', afin d'y ajouter une coiffe[1] méthylguanosine. Cette coiffe a plusieurs rôles, mais on retiendra surtout qu'elle empêche l'action de ribonucléase sur celui-ci, en plus de faciliter son export vers le cytoplasme et le recrutement de ribosomes.
Ensuite, il est modifié à son extrémité 3', où une queue poly-A (adénine) y est ajoutée, afin qu'elle aussi puisse faciliter l'export de l'ARN en dehors du noyau.
Le produit final obtenu après toutes ces opérations est l'ARN messager, ou ARNm.
La traduction
Une fois l'ARN messager mature, il est exporté en dehors du noyau, afin de recruter les ribosomes et procéder à la traduction.
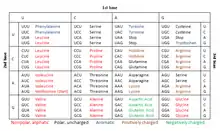
En effet, il existe 4 types de bases azotées : A, T (ou U dans l'ARN), G et C. Les nucléotides sont donc lus par groupes de 3, les codons. Chaque codon code un acide aminé, ou permet d'initier ou stopper la traduction.
Une fois que le ribosome est venu s'installer sur le brin d'ARNm, il va parcourir celui-ci jusqu'à trouver le premier codon AUG qui permet de démarrer la traduction. Le ribosome va ensuite lire chaque codon, qui se traduira par la production d'un acide aminé. On obtient ainsi la production d'une chaîne d'acides aminés, autrement dit d'une protéine. La traduction prend fin lorsque le ribosome rencontre un codon stop.
Ainsi, à la fin de ce processus, nous obtenons un produit fonctionnel du gène : une protéine.
Les cascades de gènes
Comme nous venons de le mentionner, le but de la traduction est de produire le produit final fonctionnel d'un gène. Ce produit, une protéine, peut dans certains cas être un facteur de transcription servant à transcrire un autre gène. Une fois transcrit, ce gène peut lui aussi produire le même genre de produit pour aller transcrire un autre gène et ainsi de suite, jusqu'à transcrire un gène qui produira une protéine final ayant un autre but[2]. On parle dans ce cas de cascade de gènes.
Les allèles
Le locus d'un gène ne change pas d'une personne à l'autre. Cependant, chez une même personne, il peut exister deux versions différentes d'un même gène sur le même chromosome, autrement dit, une version différente sur chaque chromatide. Cela s'appelle un allèle. L'allèle est donc une version du gène, et il peut en exister plusieurs. Ainsi, le gène étant un caractère héréditaire, chacun des parents peut nous avoir transmis des allèles différents pour un même gène - l'hétérozygotie, ou alors le même allèle - l'homozygotie.
L'homozygotie et l'hétérozygotie sont deux conditions qui jouent un grand rôle dans l'expression des gènes. Pourquoi ? Parce qu'il existe ce qu'on appelle le phénomène de dominance de l'allèle.
Lorsqu'un individu est hétérozygote, et donc qu'il possède deux versions différentes d'un même gène, et qu'un seul de ces allèles est exprimé, on dit de cet allèle qu'il est dominant. À l'inverse, on dit de l'allèle non exprimé qu'il est récessif. Ainsi, un allèle dominant n'a besoin d'être présent qu'en un seul exemplaire pour être exprimé, tandis que l'individu doit être homozygote pour l'allèle récessif afin qu'il s'exprime.
Cependant, il existe d'autres concepts que la simple dominance.
Pour la suite des concepts, nous croisons deux parents homozygotes, respectivement pour l'allèle dominant produisant un phénotype spécifique et l'autre pour l'allèle récessif, produisant un phénotype différent.
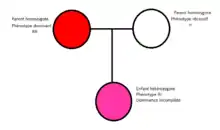
Il existe ce qu'on appelle la dominance incomplète. Lors de cette situation, la génération hétérozygote obtenue à partir de ce croisement présente un phénotype intermédiaire. Ce n'est ni le phénotype dominant, ni le phénotype récessif, mais plutôt un phénotype entre les deux.

Il y a aussi ce que l'on appelle la co-dominance. Dans cette situation, la génération fille obtenue exprime les deux phénotypes, plutôt qu'un phénotype intermédiaire. L'exemple par excellence est celui du groupe sanguin d'un individu. Dans ce cas il existe 3 allèles : A, B et o. Les allèles A et B sont des allèles dominants, car dans le cas d'hétérozygotes A/o ou B/o, seul l'allèle A ou B est exprimé. Cependant, pour des hétérozygotes A/B, les deux allèles seront exprimés, il n'y aucune dominance sur l'autre.
Les mutations ponctuelles

Lors de la traduction, les nucléotides sont lus par groupe de trois, permettant la synthèse d'un acide aminé correspondant. Cependant il est possible que le brin matrice d'ADN ait été endommagé avant la transcription. Il existe quatre types de mutations ponctuelles : transition, transversion, insertion et délétion[3]. La transversion et la transition consistent au remplacement d'un nucléotide par un autre. Ce genre de mutation peut ne rien changer, comme avoir un impact important sur le corps. En effet, le code génétique étant redondant, il existe plusieurs combinaisons possibles pour un même acide aminé. Ainsi, la mutation survenue peut mener à la synthèse du même acide aminé de départ. En revanche, dans le cas contraire, l'acide aminé synthétisé peut être différent, altérant de cette façon la protéine produite. C'est le cas par exemple dans le cas de la drépanocytose. La chaîne alpha de l'hémoglobine est normale, tandis la chaîne bêta est modifiée en une position : l'acide aminé valine est remplacé par la glutamine. Le résultat est que le globule rouge est déformé, prenant une forme de faucille allongée, pouvant mener à de graves problèmes vasculaires.
En ce qui concerne les insertions et les délétions, ce sont des mutations entraînant de graves modifications dans la structure de la protéine finale, dans la mesure où le cadre de lecture est complètement décalé.
L'épissage alternatif
Lors de la maturation des ARNm, on passe par l'étape de l'épissage. Durant cette étape, une fois que les introns ont été clivés, les exons sont recollés ensemble, mais leur ordre peut être altéré. On parle alors d’épissage alternatif[4]. Grâce à cela, un seul gène peut permettre la synthèse de plusieurs protéines différentes.
Hétérotopie, hétérotypie, hétérochronie

L'hétérotopie est un changement de lieu d'expression d'un gène. En effet, certains gènes du développement sont exprimés localement, entraînant le développement de différentes structures. Par exemple, chez la drosophile, on retrouve sur l'axe antéro-postérieur les gènes entrainant le développement de la tête, des pattes, du thorax, des ailes, etc. et ce dans cet ordre. De cette façon, en changeant la place de certains gènes du développement, on peut se retrouver par exemple avec des pattes à la place des antennes chez la drosophile[5].
L'hétérotypie quant à elle réfère à l'expression d'une chose différente. Le meilleur exemple reste encore celui de la drépanocytose, où un autre acide aminé est produit, entraînant une déformation cellulaire.
Finalement, l'hétérochronie désigne un changement dans le timing d'expression d'un gène. Un gène pourrait donc être exprimé plus tôt, plus tard, pendant une plus longue ou courte durée. Ce phénomène entraîne des modifications directes sur le phénotypes de l'individu. On peut prendre par exemple le cas de l'homme. En effet, le corps humain se développe plus rapidement que ses organes reproducteurs, ce qui est l'exemple parfait de la péramorphose, qui est une catégorie de l'hétérochronie[6].
La co-option de gènes
Le concept de co-option des gènes est un des phénomènes qui illustrent le rôle que joue les gènes dans l'évolution et le développement. Ce concept apporte l'idée qu'un gène ayant une fonction dans le développement peut évoluer et jouer un nouveau rôle. Par exemple, le gène Distal-less permet la formation d'un organe d'équilibre de vol chez la mouche, des ailes chez la chauve-souris, des tentacules chez la pieuvre, et des bras chez l'étoile de mer. La co-option est donc un phénomène qui produit de gros impacts sur le développement et le phénotype final d'un individu, mais pourrait être aussi une des nombreuses explications de l'évolution des espèces au cours du temps.
Promoteur et enhancers (amplificateurs)
L'expression d'un gène n'est pas simplement dépendante de la séquence de nucléotides entre le codon “start” et le codon “stop” de l'ARNm qu'il traduit.
En effet, certaines autres séquences telles que les promoteurs et les enhancers (amplificateurs) sont essentielles à l'expression correcte des gènes.
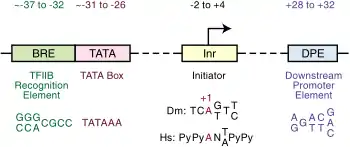
Les promoteurs
Les promoteurs sont une séquence de nucléotides (entre une dizaine et une centaine de nucléotides) situés en amont du codon start. C'est à cette séquence que le ribosome se fixe pour initier la traduction du transcrit. Pour être traduit, un ARNm doit absolument avoir une région promotrice proche en amont du codon start.
Les enhancers
Un enhancer est une séquence de nucléotides sur laquelle viennent se fixer des facteurs de transcription. Contrairement aux promoteurs, ils ne sont pas nécessairement situés juste avant le codon start. Effectivement, un enhancer peut être plusieurs centaines de milliers de bases en amont du codon start, voire même complètement ailleurs dans la séquence d'ADN mais rapproché par la conformation 3D.
Les enhancers peuvent être de deux types : activateurs, lorsqu'ils stimulent l'expression d'un gène ou répresseurs (silencer) quand ils agissent négativement sur celle-ci. Les analyses génétiques ont montré que chez l'Humain, on compte beaucoup plus d'enhancers que de gènes. Un enhancer étant responsable de l'activation ou de la suppression de l'activité d'un gène, cette observation amène à se poser la question du mode de fonctionnement de ceux-ci.
Il faut noter que même si les recherches discutées à la suite de cet article traitent d'expériences sur des enhancers liés à des gènes de développement, tout gène possède au moins un enhancer.
La redondance des enhancers
Une étude menée sur le développement des membres chez les souris a estimé en moyenne à trois le nombre d'enhancers par gène lié au développement de membres et à huit celui d'enhancers par gène lié au recrutement de facteurs de transcription liés à cette même activité. En rendant inactifs lors du développement embryonnaire (knock-out par CRISPR) certains enhancers chargés du recrutement de facteurs de transcription liés au développement des membres, l'étude a déterminé que ceux-ci fonctionnent de façon redondante. Effectivement, en désactivant un à un les enhancers et observant le développement des membres des souris, aucun n'a eu de développement anormal. Ainsi, il a été conclu que la désactivation d'un enhancer n'empêche pas l'expression normale d'un gène et donc qu'un autre enhancer est capable d'assumer le même rôle.
Cependant, en supprimant par knock-out plusieurs enhancers dont l'activité permet l'expression d'un même gène, l'étude constate que, cette fois-ci, le développement des membres se retrouve affecté. Il semble donc que les enhancers soient redondants jusqu'à un certain point puisque la suppression d'un seul n'empêche pas le développement mais celle de deux peut causer des anormalités développementales. Dans l'éventualité d'une mutation touchant un enhancer, la redondance permet d'assurer la fonction de l'enhancer touché[7].
Enhancers forts et faibles
Malgré l'activité redondante des enhancers, chacun n'agit pas avec la même force. Effectivement, parmi plusieurs enhancers ayant la même cible, certains sont dits forts et d'autres faibles. On distingue la catégorie d'enhancers la plupart du temps par sa distance par rapport au promoteur : fort (aussi appelé primaire) si les deux sont rapprochés, faible (aussi appelé ombre) si la distance est plus importante. Utilisant des chromosomes artificiels bactériens, une étude menée sur des embryons de souris a cherché à caractériser le mode de fonctionnement de ces deux catégories. Il semblerait que les enhancers forts entrent en relation plus fréquemment avec le promoteur et, soient ainsi souvent en compétition les uns avec les autres. Ainsi, avec deux enhancers forts, la quantité des facteurs de transcriptions pour lesquels leur activité est commune est moindre que si l'un d'entre eux est désactivé. Cependant, les enhancers faibles, généralement situés un peu plus à distance du promoteur et donc moins souvent en contact avec, agissent de façon additive; c'est-à-dire que la présence de plusieurs enhancers faibles à activité redondante augmente la concentration des facteurs de transcriptions leur étant associés.
La force d'un enhancer ne dépend pas seulement de sa distance avec le promoteur mais aussi de sa position dans l'organisme. Effectivement, cette même étude a révélé que la force d'un enhancer peut changer selon la quantité d'un facteur de transcription à sa proximité. Ainsi, un même enhancer peut être fort en position antérieure de l'embryon est faible en position postérieure en raison de la concentration d'un certain facteur de transcription. Par exemple, un enhancer du gène “hunchback” (responsable de la segmentation chez la drosophile) est fort ou faible selon la concentration du facteur de transcription bicoid[8].
La redondance et la différence de force des enhancers sont primordiales à leur fonctionnement lorsqu'ils doivent faire face à un stresse et leur permet de continuer à assurer leur fonction développementale. En effet, une équipe de chercheurs a confronté des embryons de drosophiles à des températures extrêmes et observer le développement de trichomes au stade larvaire. Les observations ont été effectuées sur des embryons normaux ou avec l'enhancer faible du gène shavenbaby (responsable de l'apparition de trichomes sur la larve) désactivé par knock-out et dans des conditions de températures idéales à la croissance ou extrêmes. On constate que l’absence de ce enhancer n'a aucun impact dans les conditions optimales. Toutefois lorsque l'embryon se développe dans des conditions extrêmes, l'enhancer faible est nécessaire. Ainsi, lorsqu'il est présent, les trichomes se développent de façon normale sur la larve. En revanche, en son absence, il y a une perte des trichomes, effet qui peut être inversé en implantant à nouveau cet enhancer transgéniquement. Il a été conclu qu'en situation de stress, lorsque l'enhancer fort ne peut plus effectuer sa tâche correctement, l'enhancer faible est recruté et permet le développement normal de la larve de drosophile[9].
Notes et références
- A K Banerjee, « 5'-terminal cap structure in eucaryotic messenger ribonucleic acids. », Microbiological Reviews, vol. 44, , p. 175-205 (ISSN 0146-0749, PMID 6247631, PMCID 373176, lire en ligne, consulté le )
- Comparative studies of gene expression and the evolution of gene regulation, Irene Gallego Romero, Ilya Ruvinsky, Yoav Gilad
- Lansing M. Prescott, Linda M. Sherwood et Christopher J. Woolverton (trad. de l'anglais), Microbiologie, Bruxelles/Paris, De Boeck Supérieur, , 1088 p. (ISBN 978-2-8041-6012-8, lire en ligne)
- Alberts et al., Biologie moléculaire de la cellule, Paris, Lavoisier, , page 415
- Targeted gene expression as a means of altering cell fates and generating dominant phenotypes, Andrea H. Brand,* and Norbert Perrimon, Department of Genetics and 2Howard Hughes Medical Institute, Harvard Medical School, Boston, Massachusetts 02115,USA
- The evolution of gene expression levels in mammalian organs
- (en) Osterwalder Marco, « Enhancer redundancy provides phenotypic robustness in mammalian development », Nature, , p. 239-266 (lire en ligne)
- (en) Bothma Jacques P, « Enhancer additivity and non-additivity are dertermined by enhancer strenght in the Drosophilia embryo », eLIFE, (lire en ligne)
- (en) Frankel Nicolas, « Phenotypic robustness conferred by apparently redundant transcriptional enhancers », Nature, , p. 490-493 (lire en ligne)
Voir aussi
- Portail de la biologie cellulaire et moléculaire