Extraction du zinc
La métallurgie extractive du zinc est l’ensemble des opérations permettant la fabrication de zinc métallique à partir du minerai, ou plus rarement à partir de déchets métallurgiques, d'aciéries notamment.
Le minerai (généralement la blende) est préalablement traité par flottation afin de séparer, le sulfure de sa gangue (silicate, carbonate etc). On obtient un concentré de sulfure de zinc et de sulfure de plomb.
Il existe alors deux voies de traitements :
- la pyrométallurgique ;
- l’hydrométallurgique suivi d’une opération d’électrométallurgie.
Données économiques
En 2002, la production mondiale de « zinc-métal » a été de 9502 kT.
La production de métal à partir du minerai représente environ 70 % de la production, 30 % provenant du recyclage.
Histoire de la production du zinc
Au commencement l'Inde
D'après l'archéologue Paul Cradock[1],[2], les Indiens avaient inventé au XIIe siècle un procédé d'extraction du zinc. Ce procédé, exploité à Zawar jusqu'au XVIIIe siècle, a été décrit par des lettrés dans divers ouvrages comme le Rasaratnassamuchchaya (XIVe siècle). Basé sur la condensation de la vapeur de zinc, il présente des similitudes avec les procédés industriels modernes.
Le minerai (sulfure de zinc, aujourd'hui appelé blende) était « grillé » pour obtenir de l'oxyde de zinc (voir le paragraphe Grillage du sulfure). L'oxyde ainsi obtenu, mélangé avec diverses matières organiques (source de carbone) et de la dolomie, était placé dans un creuset de terre de forme allongé. Ce pot était appelé aubergine. Une baguette de bois était plantée dans le mélange afin de créer un conduit par lequel circulera le gaz pendant la chauffe. Le creuset était fermé par un couvercle muni en son centre d'un long conduit servant de condenseur.
Plusieurs aubergines étaient placées dans un four, le condenseur dirigé vers le bas. La charge ainsi constituée était chauffée par un feu qui brûlait au-dessus. La chaleur résultant du feu provoquait la vaporisation du zinc. Celui-ci se condensait dans les conduits des condenseurs situés dans la partie basse du dispositif (donc plus froide).
La Chine au XVIe siècle...
Bien qu'il existe diverses hypothèses, la production de zinc en Chine est avérée au XVIe siècle ; le procédé étant décrit dans le livre Tien-kong-kai-ou datant du XVIIe siècle.
À l'inverse du procédé indien, les chinois utilisent la smithsonite (carbonate de zinc de formule ZnCO3, souvent appelé calamine). Ce minerai, mélangé avec du charbon de bois, était placé dans un pot fermé par une plaque de fer et chauffé, le zinc condensé étant collecté dans un creuset placé au-dessus du mélange. La circulation du gaz était assurée par un tube sortant du pot.
L'Europe au XIXe siècle

Plusieurs méthodes ont été expérimentées au XVIIIe siècle pour extraire le zinc de ses divers minerais.
- En 1742, le chimiste suédois Anton von Swab distilla du zinc à partir de la calamine
- En 1744 le même Anton von Swab en distille à partir de la blende.
- De façon indépendante, Andreas Sigismund Marggraf réduisit de la calamine en 1746 et démontra que le zinc pouvait être extrait de la blende.
- C'est William Champion (1709-1789) qui fera, à partir de la calamine, la première tentative industrielle de production de zinc à l'aide d'un condenseur ressemblant aux condenseurs indiens. Il installa son usine en 1743 à Bristol en Angleterre. Son procédé était basé sur des creusets verticaux prolongés dans le bas de condenseurs trempant dans de l'eau pour les refroidir. Il fallait soixante dix heures pour produire 400 kg de zinc. La production annuelle de l'usine est estimée à environ 200 tonnes par an. Le procédé consommait beaucoup d’énergie.
- Johan Ruberg (1751-1807) à partir de 1798 en Silésie améliore le procédé par des creusets horizontaux, permettant un chargement et un déchargement sans refroidir l'installation, c'est-à-dire en améliorant nettement le rendement énergétique. Ce procédé a inspiré de nombreuses usines en Europe et notamment en Belgique dans la région de Liège où Jean-Jacques Daniel Dony (1759-1819) créa une première usine en 1805 puis en 1810 dans le faubourg Saint-Léonard de Liège. Dony y a encore modifié le principe des creusets horizontaux. La Belgique étant alors sous domination française, Napoléon Ier lui a accordé la concession du gisement belge le plus riche en zinc (Moresnet/La Calamine). Ces usines belges sont à l'origine de la Société des Mines et Fonderie de la Vieille Montagne (créée en 1837) qui devint rapidement leader dans la production de zinc.

Production nord-américaine
Elle ne démarra qu'en 1850 en utilisant le procédé de Dony. La mine de Red Dog, exploitée depuis 1989, est actuellement la plus grande mine à ciel ouvert de zinc d'Amérique du Nord.
Dans le monde
En 1907, la production était de 737 500 tonnes, dont 31 % provenait des États-Unis, 31 % d'Allemagne, 21 % de Belgique.
Extraction minière

Comme beaucoup de métaux non ferreux, la teneur en métal des minerais n'a jamais cessé de baisser. Les minerais de zinc sont souvent associés à la présence de plomb et d'argent et, dans ce cas, ils sont extraits ensemble. Le zinc peut également être trouvé associé avec du cuivre, comme dans la grande mine de minerais pauvres d'Antamina, au Pérou[3].
Extraction par pyrométallurgie

Le procédé pyrométallurgique est constitué des opérations suivantes :
- grillage du sulfure pour obtenir un oxyde de zinc,
- réduction de l’oxyde
- affinage par liquation et distillation
Grillage du sulfure
Le grillage a pour but de transformer le sulfure en oxyde. L’obtention de l’oxyde de zinc ZnO est réalisée à une température comprise entre 910 °C et 980 °C. L’oxyde obtenu est appelé « calcine »[4].
La réaction est exothermique.
Réduction de l’oxyde
Pour réduire l’oxyde de zinc, il faut le chauffer à une température supérieure à la température de vaporisation du zinc (907 °C). Tous ces procédés sont basés sur le chauffage de l’oxyde pour obtenir le zinc sous forme gazeuse, par réaction carbothermique. Le zinc est récupéré par condensation de ce gaz.
Procédé en creuset vertical
Un mélange de calcine, fine de charbon et d'un liant est après cokéfaction placé dans un creuset de carbure de silicium d’une dizaine de mètres de haut et d’une section rectangulaire d’environ 2 m par 0,3 m. Le creuset est alimenté en continu par le haut et il est chauffé à une température comprise entre 1 280 °C et 1 320 °C. L’oxyde de zinc se réduit au contact du carbone en zinc métallique, selon la formule :
À l’issue de la réaction, le zinc est gazeux et encore mélangé à du monoxyde de carbone gazeux. À partir de ce mélange récupéré en haut du creuset, le zinc est condensé à l’aide d’une turbine.
Procédé en creuset horizontal
Le creuset est en terre réfractaire et d’une capacité relativement réduite. Il est constitué d’une chambre dans laquelle sera placé un mélange calcine, charbon (en excès). Elle est prolongée par un condenseur qui servira à condenser les vapeurs de zinc et d’une allonge qui collectera les gaz et en particulier le monoxyde de carbone qui sera brûlé à la sortie.
Compte tenu de la faible capacité des creusets, ils sont associés en batterie. Les creusets sont chauffés pendant une durée de un à deux jours à 1 200 °C. Le rendement de ce procédé est relativement faible en comparaison des autres procédés.
Procédé Imperial smelting
Ce procédé est utilisé quand on veut extraire d’autres métaux (cuivre, or, antimoine, bismuth, argent) présents dans le minerai. Le procédé comporte des similitudes avec celui de l’extraction de la fonte dans un haut-fourneau. On mélange dans le four de la calcine et du coke. Ce mélange s’écoule de haut en bas. La combustion du coke en bas du four produit du monoxyde de carbone. Ce gaz réducteur monte et réduit l’oxyde de zinc en zinc métal.
Le zinc se gazéifie et est collecté en haut du dispositif, tandis que le plomb liquide s’écoule avec un laitier contenant divers oxydes : SiO, Al2O3, CaO, SO2. En s'écoulant, le plomb emmène d’autres éléments métalliques qui peuvent être valorisés.
Le mélange gazeux capté en haut du four contient environ 8 % de zinc, 25 % de monoxyde de carbone et 11 % de dioxyde de carbone.
Le gaz traverse une pulvérisation de gouttelettes de plomb en fusion à une température de 550 °C. On récupérera 1 tonne de zinc pour 400 tonnes de plomb. À la sortie du condenseur, le mélange plomb-zinc est traité par liquation (le zinc liquide flottant sur le plomb) afin de séparer le plomb du zinc, qui contient encore 1,5 % de plomb.
Affinage : liquation, distillation
Le zinc obtenu lors des opérations précédentes contient encore du plomb et d’autres impuretés (fer, cadmium dans des proportions de l’ordre de 0,1 %). Pour augmenter le titre en zinc du métal, il est affiné par deux opérations : la liquation et la distillation.
La liquation est basée sur une différence de miscibilité entre le plomb et le zinc à une température comprise entre 430 °C et 440 °C. De même, la solubilité du fer décroît fortement lorsque l’on refroidit le mélange fer- zinc.
En traitant le zinc issu des opérations précédentes dans un four à réverbère à une température comprise entre 430 °C et 440 °C pendant un à deux jours, on sépare le zinc qui contient encore 0,9 % de plomb de ce qui s’appelle la ‘’matte de zinc’’ contenant du plomb, 5 à 6 % de zinc et un composé ferreux de composition FeZn13.
Pour obtenir un zinc pur, il faut passer par une opération de distillation fractionnée qui permet de séparer les différents constituants métalliques en jouant sur leurs températures de fusion. Pour cela, on chauffe le mélange de métaux pour le rendre gazeux. À l’aide de diverses colonnes de distillation, on sépare les métaux en les condensant.
Extraction par hydro-électrométallurgie
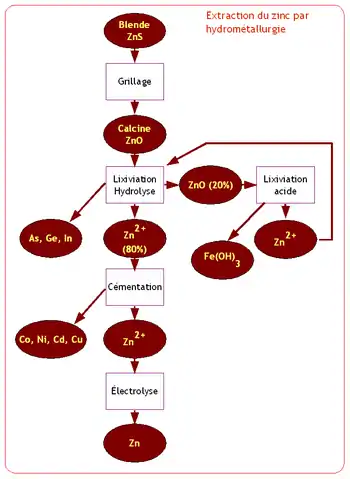
Le procédé hydrométallurgique est composé des opérations suivantes :
Lixiviation
Par cette opération, on traite soit de la calcine issu de l’opération de grillage, soit directement le sulfure de zinc, ce dernier procédé étant plus récent que le traitement de l’oxyde de zinc.
Le but de la lixiviation est de mettre en solution le zinc sous forme de l’ion Zn2+ en obtenant la transformation soit du sulfure de zinc issu directement du minerai, soit l’oxyde de zinc (calcine) issu du grillage en sulfate de zinc (ZnSO2+).
Traitement du sulfure de zinc
Le sulfure est traité par action de l’acide sulfurique en milieu oxydant pour obtenir du sulfate de zinc et du soufre sous forme solide. La réaction avec l’acide sulfurique en présence de oxygène est lente. On utilise comme oxydant l’ion Fe3+.
La réaction globale est la suivante :
Lixiviation hydrolyse
On place la calcine en présence d’une solution très diluée d’acide sulfurique. Cette opération permet la mise en solution de 80 % du zinc sous forme de sulfate de zinc. On élimine certaines impuretés métalliques : arsenic, germanium et indium en injectant des ions ferreux (Fe2+) qui précipitent en hydroxyde de fer (Fe(OH)3) en entraînant ces composés.
On sépare par décantation la solution d’ions zinc qui sera traitée par cémentation puis électrolysée. Les boues contenant encore 20 % du zinc sous forme d’oxyde sont traitées par ‘’lixiviation acide’’.
Lixiviation acide
La mise en solution des 20 % de zinc restant est obtenue en utilisant de l’acide sulfurique concentré. Le fer et le cuivre sont également solubilisés.
La solution décante pour séparer les éléments solubilisés des déchets solides résiduels du minerai et de certains éléments insolubles.
On extrait le fer de la solution contenant le zinc en le précipitant sous forme d’hydroxyde ferrique (Fe(OH)3). La solution de zinc ainsi obtenue sera réintroduite dans l’opération de lixiviation hydrolyse.
Cémentation
Le but de la cémentation de la solution issue de l’opération de lixiviation hydrolyse est de retirer les éléments : cobalt, nickel, cadmium et cuivre. Ces éléments ayant été solubilisés sous forme d’ions.
Le principe est de mettre en contact l’ion métal (exemple Cu2+) avec un métal ayant un pouvoir réducteur plus important (moins électronégatif). On utilise ici de la poudre de zinc fine.
On a une réaction du type :
L’opération se fait par plusieurs cémentations successives. La difficulté d’extraire les éléments suit l’ordre suivant par difficulté croissante : Cuivre, Cadmium, Nickel, Cobalt. On joue en particulier sur la température (entre 45 °C et 65 °C pour le cadmium, 75 °C et 95 °C pour le cobalt).
Les liquides et les solides sont séparés par filtration.
Électrolyse
L’électrolyse est effectuée en faisant passer un courant électrique entre deux électrodes dans la solution de sulfate de zinc obtenue à l’issue de l’opération de cémentation.
Elle met en jeu les réactions suivantes :
- Cathode en aluminium :
et
- anode en plomb :
La réaction globale est :
L’installation est constituée de cellules comportant chacune jusqu’à quatre-vingt six cathodes (sur des installations dites Superjumbo). Pour une installation de cette taille, cela représente une surface de 3,2 m2 d électrode. Le zinc est récupéré par action mécanique sur les cathodes.
L’électrolyte est à une température de 30 à 40 °C. La tension d’équilibre théorique est de 2,022 V. Compte tenu des différents phénomènes physiques, de la géométrie de l’installation, les tensions réelles sont de 3,2 à 3,7 V pour des intensités variant de 400 à 700 A/m2. La consommation électrique est de 2 950 à 3 500 kWh/t de zinc produit.
Voir aussi
Articles connexes
Bibliographie
- Fathi Habashi, Discovering the 8th metal, publié par l’ International Zinc Association (http://www.zincworld.org/ ), consultable sur (PDF)
- Pierre Routhier, Voyage au monde du métal : inventions et aventures, Paris, Belin, coll. « Regards sur la science », , 159 p. (ISBN 978-2-7011-2403-2, OCLC 1040412308), « Un métal volatil capturé en Asie : le zinc », p. 100 à 105.
- Michel Darcy, Métallurgie du zinc, M2770, , éditions Techniques de l’ingénieur.
- Jean Philibert, Alain Vignes, Yves Bréchet, Pierre Combrade, Métallurgie, du minerai au matériau, Chapitre 14 : l’élaboration du zinc, page 225 à 232, Édition Dunod, 2e édition, 2002 (ISBN 2-10-006313-8).
Notes et références
- Cf. P. T. Craddock (dir.), I. C. Freestone, L. K. Gurjar, A. P. Middleton et L. Willies, 2000 years of zinc and brass, Londres, British Museum, (réimpr. 1998, ed. rev.), 258 p. (ISBN 978-0-86159-124-4 et 0-86159-124-0), « Zinc in classical antiquity », p. 1–3.
- Cf. P. T. Craddock et al. Ibid., pp. 35–46.
- (en) Gavin M. Mudd, « The “Limits to Growth” and ‘Finite’ Mineral Resources : Re-visiting the Assumptions and Drinking From That Half-Capacity Glass », , p. 5
- La valorisation de l'acide sulfurique produit a amené certaines entreprises à quitter le zinc pour se lancer dans d'autres productions (par exemple, Prayon et les superphosphates).
- Portail des sciences des matériaux
- Portail des technologies