Filariose lymphatique
La filariose lymphatique, est une maladie tropicale, infectieuse et plus précisément parasitaire provoquée par des vers parasites du genre filaire Wuchereria bancrofti (filariose de Bancroft), Brugia malayi (filariose de Malaisie) et Brugia timori, toutes transmises par les moustiques. C’est une affection extrêmement rare dans les pays occidentaux[1].
| Symptômes | Éléphantiasis, épididymite, lymphadénite et abcès |
|---|
| Médicament | Albendazole |
|---|---|
| Spécialité | Infectiologie |
| CIM-10 | B74.0 |
|---|---|
| CIM-9 | 125.0 |
| DiseasesDB | 29234 |
| eMedicine | 1109642 |
| MeSH | D004605 |
![]() Mise en garde médicale
Mise en garde médicale
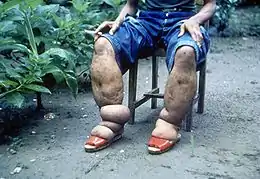
Le symptôme le plus spectaculaire de la filariose lymphatique est l’éléphantiasis qui provoque un épaississement de la peau et des tissus sous cutanés. Ce fut la première maladie transmise par des insectes à être découverte. L’éléphantiasis survient quand les parasites envahissent le système lymphatique.
Les filarioses lymphatiques se distinguent des filarioses cutanées comme l'onchocercose et la loase.
Historique
En 1866, Otto Wucherer a prouvé la présence de microfilaires ou de larves filaires, dans l’urine. En 1871, Timoth Lewis a découvert la présence de microfilaires dans le sang périphérique ; plus tard, en 1876, Joseph Bancroft découvre la forme adulte du parasite. Enfin en 1878, Patrick Manson observe le développement de W.bancrofti chez les moustiques du genre Culex[2].
Morphologie du parasite
W.bancrofti présente une grande différence de taille entre le mâle et femelle. Cette différenciation est connue sous le nom de dimorphisme sexuel. Le ver masculin adulte est long et mince et mesure entre quatre et cinq centimètres de longueur, un dixième de millimètre de diamètre, et possède une queue incurvée. La femelle, en revanche, est longue de six à dix centimètres, et a un diamètre trois fois plus grand que le mâle. Cette différence de taille peut être expliquée par le grand nombre de microfilaires que la femelle produit chaque jour.
Cycle du parasite
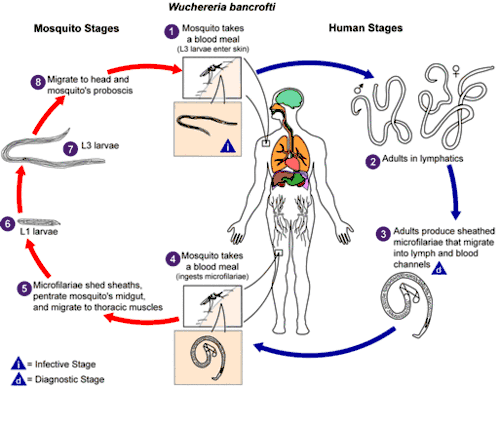
W. bancrofti effectue son cycle parasitaire chez deux hôtes. Les êtres humains jouent le rôle d’hôtes définitifs et les moustiques celui d’hôtes intermédiaires.
À l’âge adulte les parasites résident dans les vaisseaux lymphatiques. Ils sont vivipares. Les larves du premier stade sont connues sous le nom de microfilaires. Les microfilaires sont présentes dans le système circulatoire et migrent alternativement entre la circulation profonde, le jour, et la circulation périphérique, la nuit.
Ensuite, le ver est transféré dans un vecteur. Les vecteurs les plus communs sont des espèces de moustique : Anopheles, Culex, Aedes et Mansonia. À l'intérieur de leur deuxième hôte, il mûrit pour devenir une larve mobile. Quand son hôte intermédiaire se nourrit, il est projeté dans le courant sanguin de son nouvel hôte humain.
Les larves se déplacent vers les ganglions du système lymphatique, principalement dans les membres inférieurs et les organes génitaux, et se transforment en ver adulte au bout d’un an. À ce moment, une femelle adulte sera capable de donner elle-même naissance à des microfilaires.
Répartition géographique
La filariose est endémique dans les régions tropicales d’Asie, d’Afrique, d’Amérique centrale et d’Amérique du Sud avec 51,4 millions de personnes infectées en 2020[3] (120 millions de personnes étaient infectées en 2010) mais seules un tiers des personnes vont en manifester les signes[4]
Dans certaines régions endémiques du monde (par exemple, Malaipea en Indonésie), jusqu'à 54 % de la population peut avoir des microfilaires dans leur sang[5].
Physiopathologie
La filaire provoque probablement des anomalies du système immunologique expliquant la tolérance du sujet contaminé devant un parasitime pouvant être important[6]. Seuls un tiers des sujets contaminés développent la maladie sans que la raison en soit claire : rôle d'une surinfection bactérienne sur des vaisseaux lymphatiques endommagées[7] ? rôle du facteur de croissance de l’endothélium vasculaire A et C[8] ? Facteurs génétiques[9] ?
Un germe, le Wolbachia, semble être en endosymbiose avec la filaire, lui permettant de moduler l'immunité du patient contaminé et de provoquer une réaction inflammatoire[10]. Cela pourrait expliquer l'efficacité de la doxycycline, actif sur le wolbachia mais pas sur les filaires, dans les symptômes de la maladie.
Signes cliniques
La contamination s'effectue dès l'enfance mais les premiers signes surviennent souvent vers l'adolescence[11].
Le début des symptômes est progressif, mais les effets sont très apparents au bout de plusieurs années. Pendant l'étape inflammatoire initiale, un hôte peut présenter de l’œdème, des plaies, et des troubles circulatoires. Puis, les ganglions lymphatiques sont gonflés et dilatés puis ils sont durcis et obstrués par du tissu fibreux, et cela empêche le système lymphatique de fonctionner correctement. Les microfilaires provoquent également le gonflement, l'épaississement, et la décoloration de la peau. Sans drainage approprié des fluides sanguins et de la lymphe, le tissu affecté gonflera et il en résultera un éléphantiasis, une dilatation monstrueuse du corps qui peut parfois aboutir à la mort.
L’éléphantiasis affecte principalement les extrémités inférieures, alors que les oreilles et les muqueuses sont rarement affectées ; cependant, cela dépend des espèces de filaire. W.bancrofti peut toucher les jambes, les bras, la vulve, les seins, alors que Brugia timori atteint rarement les organes génitaux.
Diagnostic
Le diagnostic est fait en identifiant les microfliaires sur une goutte épaisse de sang après coloration de Giemsa. Le sang doit être prélevé la nuit, puisque les microfilaires circulent la nuit, quand leur vecteur, le moustique, est le plus susceptible de piquer[4].
La sérologie (détection des anticorps spécifiques dans le sang) par immunochromatographie est la méthode de choix en épidémiologie[12] puisqu'elle permet de détecter les patients porteurs du parasite mais sans signe clinique.
Il y a également des analyses par PCR disponibles pour le diagnostic.
Traitement
Les médicaments utilisés pour traiter la filariose lymphatique, dit filaricides, sont plus efficaces lorsqu’ils sont utilisés peu après infection, mais ils ont des effets secondaires toxiques. En outre, il est difficile de détecter la maladie à un stade précoce. Par conséquent, il est nécessaire d’améliorer les traitements et les tests de laboratoire.
Les symptômes graves provoqués par le parasite peuvent être évités par l'utilisation de certaines molécules. La diéthylcarbamazine[13] et le caparsolate de sodium sont utilisés pour tuer les vers et leurs microfilaires. La diéthylcarbamazine est généralement le produit le plus utilisé et est administré par voie orale. La protection est comparable à celle qui est conférée pour d'autres maladies transmises par les moustiques ; on peut utiliser des barrières à la fois physiques (moustiquaires) et chimiques (répulsifs).
L'ivermectine est efficace sur les micro-filaires mais peu sur les filaires adultes. Ces derniers pouvant pondre, un traitement très prolongée est nécessaire (toute la vie de la filaire adulte, soit 10 à 14 ans)[4].
L'albendazole est actif sur les microfilaires, peu sur les filaires adultes. Il peut être donné seul ou association avec d'autres filaricides[12].
En cas de microfilarémie importante, un traitement filaricide peut provoquer un syndrome inflammatoire, probablement par le relargage du wolbachia par les microfilaires mortes[14]. Ces médicaments ont cependant l'avantage de pouvoir être donnée en une prise unique, éventuellement complétée par une nouvelle prise un an plus tard)[4].
Une autre stratégie est l'utilisation de la doxycycline, antibiotique ciblée sur le wolbachia et pas sur la filaire. Cela entraîne une diminution notable des symptômes, une stérilisation de la filaire adulte[15] et, éventuellement, sa mort au bout d'un an[16]. De par son mécanisme, cette stratégie permet d'éviter la survenue de symptômes secondaire à la mort des microfilaires et des filaires adultes. Cela nécessite un traitement prolongé pendant plusieurs semaines (difficile dans les pays d'endémie) et est contre-indiqué chez le jeune enfant et la femme enceinte.
Pour les personnes éligibles vivant en zone d'endémie, l'OMS recommande un traitement préventif visant à réduire la prévalence de la microfilarémie. Elle consiste en différentes associations (trithérapie ou bithérapie selon le contexte) d'ivermectine, de diéthylcarbamazine, et d'albendazole[3].
La lutte contre les moustiques pourrait être également efficace[17].
Programme mondial d'élimination
L'éradication de la maladie a été proposée par l'Organisation mondiale de la santé dès 1997 sur un programme devant se terminer en 2010[18]. Une association, Global Alliance to Eliminate Lymphatic Filariasis[19], a été créée sous son égide en 2000. Près de deux milliards de traitement individuel ont été distribués en un peu moins d'une décennie, avec des résultats substantiels[20]. La régression de la maladie est particulièrement nette en Extrême-Orient, mais beaucoup moins en Afrique[21].
Ce programme d'élimination se poursuit en 2020 : l'objectif est de mettre fin à la transmission de l'infection par une administration de masse de médicaments (AMM) et de prendre en charge la morbidité et la prévention des incapacités liées à la maladie. L'AMM consiste à traiter toutes les personnes répondant à des critères dans des zones d'endémie correspondant à la plus petite unité administrative du pays en question. L'objectif est d'atteindre un niveau où la transmission ne peut plus se maintenir[3].
En 2020, 72 pays sont endémiques, 34 en Afrique et 22 dans le Pacifique occidental (régions OMS) dont 48 nécessitent une AMM. Depuis 2000, 8,6 milliards de traitement individuels ont été administrés à plus de 925 millions de personnes. La population nécessitant un traitement a été réduite de 49 %. La pandémie de Covid-19 a conduit à annuler ou reporter des activités d'AMM, et l'on s'attend à une augmentation de la transmission et de la morbidité, malgré ce des progrès ont été réalisés en 2020[3].
Notes et références
- Joseph Merrick, « Elephant Man », n'a pas été atteint par un ver parasite, mais par le syndrome de Protée.
- Jean-Paul Bado, Médecine coloniale et grandes endémies en Afrique 1900-1960, Karthala Editions,
- OMS, « Programme mondial pour l'élimination de la filariose lymphatique », Relevé épidémiologique hebdomadaire, vol. 96, no 41, , p. 497-508 (lire en ligne)
- (en) Taylor MJ, Hoerauf A, Bockarie M. « Lymphatic filariasis and onchocerciasis » Lancet 2010;376:1175-85.
- (en) Aupali T, Ismid IS, Wibowo H et al., « Estimation of the prevalence of lymphatic filariasis by a pool screen PCR assay using blood spots collected on filter paper », Tran R Soc Trop Med Hyg, vol. 100, no 8, , p. 753–9
- (en) Hoerauf A, Satoguina J, Saeftel M, Specht S. « Immunomodulation by filarial nematodes » Parasite Immunol., 2005;27:417-29.
- (en) Shenoy RK. « Clinical and pathological aspects of filarial lymphedema and its management » Korean J Parasitol. 2008;46:119-25.
- (en) Debrah AY, Mand S, Marfo-Debrekyei Y et al. « Reduction in levels of plasma vascular endothelial growth factor-A and improvement in hydrocele patients by targeting endosymbiotic Wolbachia sp. in Wuchereria bancrofti with doxycycline » Am J Trop Med Hyg. 2009;80:956-63.
- (en) Debrah AY, Mand S, Toliat MR et al. « Plasma vascular endothelial growth Factor-A (VEGF-A) and VEGF-A gene polymorphism are associated with hydrocele development in lymphatic filariasis » Am J Trop Med Hyg. 2007;77:601-8.
- (en) Turner JD, Langley RS, Johnston KL et al. « Wolbachia lipoprotein stimulates innate and adaptive immunity through Toll-like receptors 2 and 6 to induce disease manifestations of filariasis » J Biol Chem. 2009;284:22364-78.
- (en) Witt C, Ottesen EA, « Lymphatic filariasis: an infection of childhood » Trop Med Int Health 2001;6:582-606
- (en) Gyapong JO, Kyelem D, Kleinschmidt I et al. « The use of spatial analysis in mapping the distribution of bancroftian filariasis in four West African countries » Ann Trop Med Parasitol. 2002;96:695-705.
- (en) Gyapong JO, Kumaraswami V, Biswas G, Ottesen EA. « Treatment strategies underpinning the global programme to eliminate lymphatic filariasis » Expert Opin Pharmacother. 2005;6:179-200.
- (en) Cross HF, Haarbrink M, Egerton G et al. « Severe reactions to filarial chemotherapy and release of Wolbachia endosymbionts into blood » Lancet 2001;358:1873-5.
- (en) Turner JD, Mand S, Debrah AY et al. « A randomized, double-blind clinical trial of a 3—week course of doxycycline plus albendazole and ivermectin for the treatment of Wuchereria bancrofti infection » Clin Infect Dis. 2006;42:1081-9.
- (en) Taylor MJ, Makunde WH, McGarry HF et al. « Macrofilaricidal activity after doxycycline treatment of Wuchereria bancrofti: a double-blind, randomised placebo-controlled trial » Lancet 2005;365:2116-21.
- (en) Webber RH. « Eradication of Wuchereria bancrofti infection through vector control » Trans Roy Soc Trop Med Hyg. 1979;73:722-4.
- (en) Bockarie MJ, Molyneux DH. « The end of lymphatic filariasis? » BMJ 2009;338:b1686
- Site du Global Alliance to Eliminate Lymphatic Filariasis
- (en) Ottesen EA, Hooper PJ, Bradley M, Biswas G. « The global programme to eliminate lymphatic filariasis: health impact after 8 years » PLoS Negl Trop Dis. 2008;2:e317
- (en) WHO. « Global programme to eliminate lymphatic filariasis: progress report on mass drug administration in 2007 » Wkly Epidemiol Rec. 2008 ; 83 : p. 333-348
Liens externes
- Portail de la médecine
- Portail de la parasitologie