Fluorure de chlorosulfonyle
Le fluorure de chlorosulfonyle est un composé chimique de formule SO2ClF utilisé comme solvant pour composés très oxydants.
| Fluorure de chlorosulfonyle | |||
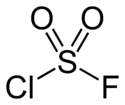 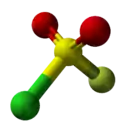 Structure du fluorure de chlorosulfonyle. |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.033.737 | ||
| No CE | 237-126-2 | ||
| No RTECS | WT4900000 | ||
| PubChem | 26159 | ||
| ChEBI | 39445 | ||
| SMILES | |||
| InChI | |||
| Apparence | gaz incolore. | ||
| Propriétés chimiques | |||
| Formule | FSO2Cl | ||
| Masse molaire[1] | 118,515 ± 0,008 g/mol Cl 29,91 %, F 16,03 %, O 27 %, S 27,06 %, |
||
| Propriétés physiques | |||
| T° fusion | −124,7 °C | ||
| T° ébullition | 7,1 °C | ||
| Solubilité | hydrolyse | ||
| Masse volumique | 1,623 g·cm-3 | ||
| Précautions | |||
| SGH[2] | |||
  Danger |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Procédures de synthèse
Avec une chloration
Au laboratoire, sa préparation commence par celle de fluorosulfite de potassium (KSO2F) [3]:
Ce sel est alors chloré en fluorure de chlorosulfonyle[4] :
Le mélange de KSO2F et de SO2ClF chauffé à 180 °C donne du fluorure de sulfuryle (SO2F2).
Autres méthodes
Le fluorure de chlorosulfonyle peut également être préparé à partir de substances non gazeuses en traitant le chlorure de sulfuryle (SO2Cl2) avec du fluorure d'ammonium (NH4F) ou du fluorure de potassium (KF) dans de l'acide trifluoroacétique (CF3COOH) [5]:
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) F. Seel, Ralph G. Czerepinski et George H. Cady, « Potassium Fluorosulfite: (Potassium Fluorosulfinate) », Inorg. Synth., vol. 9, (DOI 10.1002/9780470132401.ch29, lire en ligne)
- (en) F. Seel, Leonard C. Duncan, Ralph G. Czerepinski et George H. Cady, « Sulfuryl Chloride Fluoride and Sulfuryl Fluoride », Inorg. Synth., vol. 9, (DOI 10.1002/9780470132401.ch28, lire en ligne)
- (en) V. Prakash Reddy, Donald R. Bellew et G. K. Surya Prakash, « A convenient preparation of sulfuryl chloride fluoride », J. Fluor. Chem., vol. 56, no 2, , p. 195-197 (ISSN 0022-1139, DOI 10.1016/S0022-1139(00)81102-1, lire en ligne)
- Portail de la chimie
Cet article est issu de Wikipedia. Le texte est sous licence Creative Commons - Attribution - Partage dans les Mêmes. Des conditions supplémentaires peuvent s'appliquer aux fichiers multimédias.
