Trifluorure de plutonium
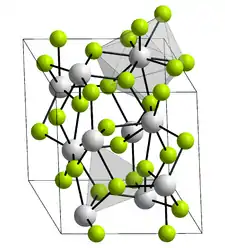
Le fluorure de plutonium(III) ou trifluorure de plutonium est le composé chimique constitué de plutonium et de fluor de formule PuF3. Il se présente sous la forme d'un solide violet cristallisé dans le système trigonal selon le groupe d'espace P3c1 (no 165)[1]. Sa structure cristalline est celle du LaF3[5].
| Trifluorure de plutonium | |
| |
| __ Pu3+ __ F− Structure cristalline du fluorure de plutonium(III) |
|
| Identification | |
|---|---|
| Nom UICPA | trifluoroplutonium |
| Synonymes |
fluorure de plutonium(III) |
| No CAS | |
| PubChem | 139624 |
| SMILES | |
| InChI | |
| Apparence | solide cristallisé violet[1] |
| Propriétés chimiques | |
| Formule | PuF3 |
| Masse molaire[2] | 301 g/mol F 18,94 %, Pu 81,08 %, |
| Propriétés physiques | |
| T° fusion | 1 396 °C[1] |
| T° ébullition | 1 957 °C[1] |
| Solubilité | pratiquement insoluble dans l'eau[3] |
| Masse volumique | 9,33 g/cm3[4] |
| Cristallographie | |
| Système cristallin | trigonal[1] |
| Classe cristalline ou groupe d’espace | P3c1 (no 165) [1] |
| Paramètres de maille | a = 709,3 pm, c = 725,4 pm[1] |
| Précautions | |
 Composé radioactif |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
Le trifluorure de plutonium, très peu soluble, est produit par métathèse en solution aqueuse dans des conditions acides entre le nitrate de plutonium(III) Pu(NO3)3 et un sel de fluorure qui le précipite[6] :
Le fluorure de plutonium(III) peut être également obtenu via l'oxalate de plutonium(IV) Pu(C2O4)2 ou le dioxyde de plutonium PuO2 avec de l'hydrogène H2 et du fluorure d'hydrogène (HF) ou l'oxalate de plutonium(III) Pu2(C2O4)3 avec simplement du fluorure d'hydrogène[3] :
Utilisation
Une méthode de précipitation du fluorure de plutonium(III) a été étudiée comme alternative à la méthode au peroxyde de plutonium pour le traitement du combustible nucléaire usé[7]. Une étude de 1957 du Laboratoire national de Los Alamos signale une récupération moins efficace qu'avec la méthode traditionnelle[8] tandis qu'une étude plus récente soutenue par l'OSTI (en) conclut qu'il s'agit d'une des méthodes les plus efficaces[9],[10].
Le trifluorure de plutonium peut être utilisé dans la fabrication de l'alliage plutonium-gallium au lieu du plutonium pur, plus difficile à manipuler.
Notes et références
- Manuel Gmelin de chimie minérale, Système no 71, Transuraniens, partie C, p. 101–104.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 2, Ferdinand Enke, Stuttgart, 1978, p. 1299. (ISBN 3-432-87813-3)
- (en) David R. Lide, « Properties of the Elements and Inorganic Compounds », CRC Handbook of Chemistry and Physics, 90e éd., CRC Press/Taylor and Francis, 2010, p. 4-81. (ISBN 978-1482287943)
- (en) A. F. Wells, Structural Inorganic Chemistry, 5e éd., Oxford Science Publications, 1984. (ISBN 0-19-855370-6)
- (en) G. A. Burney et F. W. Tober, « Precipitation of Plutonium Trifluoride », Industrial & Engineering Chemistry, Process Design and Development, vol. 4, no 1, , p. 28-32 (DOI 10.1021/i260013a009, lire en ligne)
- (en) C. K. Gupta et T. K. Mukherjee, Hydrometallurgy in Extraction Processes, vol. 2, CRC Press, (ISBN 978-0-8493-6805-9, OCLC 21197603), p. 206-208.
- (en) R. S. Winchester, Aqueous Decontamination of Plutonium from Fission Product Elements, Los Alamos, Nouveau-Mexique, Laboratoire national de Los Alamos, coll. « CIC-14 Report collection », (lire en ligne), p. 9-10.
- (en) L. L. Martella, M. T. Saba et G. K. Campbell, « Laboratory-scale evaluations of alternative plutonium precipitation methods », Rockwell International, (DOI 10.2172/5318991, lire en ligne)
- (en) K. F. Grebenkin, Yu. N. Zuev, L. N. Lokhtin, N. A. Novoselov, A. V. Panov, V. A. Simonenko, V. G. Subbotin, V. M. Berezkin, E. N. Zvonarev, O. I. Kozlov, V. I. Lobanov, V. P. Mashirev, V. V. Shatalov, A. D. Maksimov et D. Yu. Chuvilin, « Synthesis of plutonium trifluoride from weapons plutonium as a potential fuel for power reactors », Atomic Energy, vol. 83, no 2, , p. 614-621 (DOI 10.1007/BF02413891, lire en ligne)
- Portail de la chimie