Formamide
Le formamide est un amide provenant de l'acide formique. À température ambiante, il se présente comme un liquide incolore et légèrement visqueux, proche de la consistance de la glycérine. C'est un solvant hygroscopique et un réducteur d'odeur proche de celle de l'ammoniac. Il peut se transformer en acide cyanhydrique s'il est soumis à des températures supérieures à 90 °C. À des températures supérieures à 200 °C, le formamide se transforme en acide cyanhydrique, ammoniac, monoxyde de carbone et eau. Le formamide pourrait jouer un rôle clé dans la formation des molécules complexes à l'origine du vivant[11].
| Formamide | |
| |
| Identification | |
|---|---|
| Nom UICPA | Formamide |
| Synonymes |
méthanamide |
| No CAS | |
| No ECHA | 100.000.766 |
| No CE | 200-842-0 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore, hygroscopique, visqueux[1]. |
| Propriétés chimiques | |
| Formule | CH3NO [Isomères] |
| Masse molaire[2] | 45,040 6 ± 0,001 5 g/mol C 26,67 %, H 6,71 %, N 31,1 %, O 35,52 %, |
| pKa | 0,3 |
| Moment dipolaire | 3,73 ± 0,07 D [3] |
| Diamètre moléculaire | 0,431 nm [4] |
| Propriétés physiques | |
| T° fusion | 2,5 °C[1] |
| T° ébullition | (décomposition) : 210 °C[1] |
| Solubilité | dans l'eau : très bonne[1], bonne dans l'éthanol |
| Paramètre de solubilité δ | 39,3 MPa1/2 (25 °C)[5]; 17,9 cal1/2·cm-3/2[6] |
| Masse volumique | 1,133 4 g·cm-3 [7] |
| T° d'auto-inflammation | >500 °C[1] |
| Point d’éclair | 154 °C (coupelle ouverte)[1] |
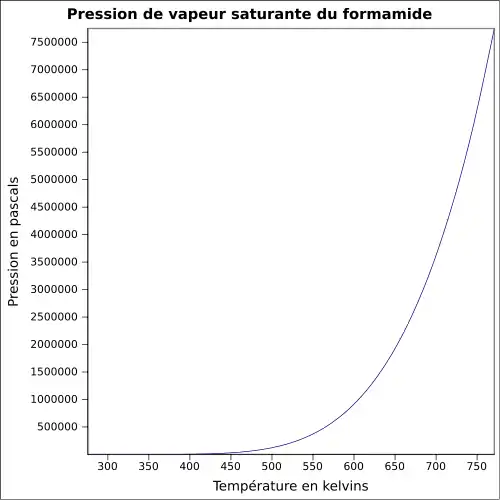
| Pression de vapeur saturante | à 20 °C : environ 2 Pa[1] |
| Thermochimie | |
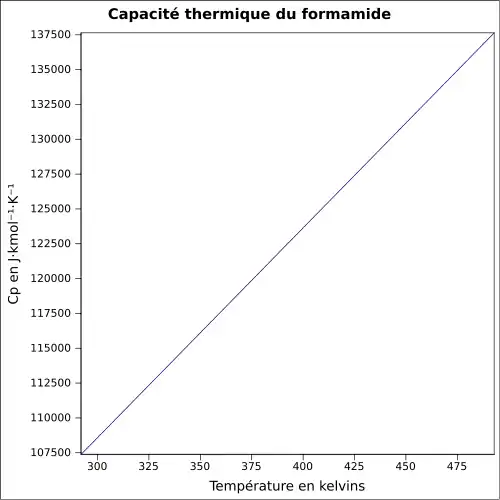
| Cp | |
| Propriétés électroniques | |
| 1re énergie d'ionisation | 10,16 ± 0,06 eV (gaz)[10] |
| Propriétés optiques | |
| Indice de réfraction | 1,446 [4] |
| Précautions | |
| NFPA 704 | |
| Directive 67/548/EEC | |
 T |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Données physiques complémentaires
- densité de vapeur : 1,55 (air = 1)
- pression de vaporisation : 0,08 mmHg (11 Pa) à 20 °C
- point éclair : 154 °C
- pKa : 23,5
- se décompose à partir de 180 °C pour donner de l'eau, de l'ammoniac, du monoxyde de carbone et du cyanure d'hydrogène
Production
La réaction entre l'acide formique et l'ammoniac produit du formiate d'ammonium, lequel peut conduire sous l'action de la chaleur au formamide :
- HCOONH4 → HCONH2 + H2O
Utilisations
Le formamide est utilisé dans les applications suivantes[12] :
- Fabrication de l'acide formique, de l'acide cyanhydrique ou de dérivés de triazines ;
- Agent de filage (copolymères de l'acrylonitrile), solvant, durcisseur et plastifiant dans la fabrication de matières plastiques
- Colles ;
- Solvant dans les encres, peintures et vernis ou la fabrication de cuirs synthétiques ;
- Émulsifiant, inhibiteur de corrosion, additif pour huiles lubrifiantes et fluides hydrauliques,
- Solvant d'extraction ;
- Produits pharmaceutiques et produits fongicides et pesticides ;
- Synthèse de vitamines ;
- Réactif analytique de laboratoire : déstabilisation des acides nucléiques (rupture des liaisons hydrogène entre les bases) ;
- Tampon favorisant la séparation et l'ionisation de composés apolaires dans les techniques séparatives analytiques, par exemple : chromatographie en phase liquide couplée à la spectrométrie de Masse en Tandem (HPLC - ESI -MS/MS).
- Synthèse du 3,4-méthylènedioxyamphétamine (MDA) (psychotrope);
Voir aussi
Liens externes
- http://www.reptox.csst.qc.ca/Produit.asp?no_produit=3731 (CSST - Service du répertoire toxicologique)
- http://docs.appliedbiosystems.com/pebiodocs/00102922.pdf (consignes de sécurité).
- https://www.cdc.gov/niosh/ipcsnfrn/nfrn0891.html (Fiches internationales de Sécurité chimique).
- http://chemsub.online.fr/name/formamide.html (ChemSub Online : Formamide.)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « formamide » (voir la liste des auteurs).
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « formamid » (voir la liste des auteurs).
Notes et références
- FORMAMIDE, Fiches internationales de sécurité chimique
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1 et 1-4200-6679-X), p. 9-50
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) James E. Mark, Physical Properties of Polymer Handbook, Springer, , 2e éd., 1076 p. (ISBN 978-0-387-69002-5 et 0-387-69002-6, lire en ligne), p. 294
- (en) Șerban Moldoveanu, Sample preparation in chromatography, Amsterdam/Boston, Elsevier, , 930 p. (ISBN 0-444-50394-3), p. 258
- (en) J. G. Speight, Norbert Adolph Lange, Lange's handbook of chemistry, McGraw-Hill, , 16e éd., 1623 p. (ISBN 0-07-143220-5), p. 2.289
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50
- (en) Carl L. Yaws, Handbook of Thermodynamic Diagrams, vol. 1, 2 et 3, Huston, Texas, Gulf Pub. Co., (ISBN 0-88415-857-8, 0-88415-858-6 et 0-88415-859-4)
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205
- L'origine de la vie simulée sur ordinateur, sur {SCIENCES²}. Consulté le 22 septembre 2014.
- « Formamide - Fiche toxicologique n°285 » [PDF], sur inrs.fr,
- Portail de la chimie