Frizzled
Les protéines transmembranaires Frizzled (Fz) sont une famille de récepteurs couplés aux protéines G (RCPG) qui tiennent notamment un rôle dans la voie de signalisation Wnt. L’activation du récepteur conduit à l’activation de la protéine Dishevelled dans le cytosol.
Fonctions
Les protéines Frizzled jouent aussi un rôle essentiel dans le contrôle de la polarité cellulaire, le développement embryonnaire, la formation des synapses, la prolifération des cellules et bien d’autres processus dans les organismes adultes ou en développement. Ces processus sont le résultat d’une des trois voies de signalisation suivantes : la voie canonique Wnt/β-caténine, la voie Wnt/calcium et la voie de la polarité cellulaire planaire (PCP)[2]. Des mutations du récepteur Frizzled 4 ont été mises en relation avec la vitréorétinopathie exsudative familiale, une maladie rare caractérisée par une vascularisation anormale de la rétine.
Parmi d’autres mécanismes, Fz joue un rôle important dans le développement de la polarité des cellules. Il est par exemple visible dans l’orientation des poils de l’abdomen et des ailes de la drosophile qui sont tous orientés vers l’extrémité distale. Fz a au moins trois fonctions dans la polarité planaire: il reçoit les informations de molécules situées en amont, il assure la réponse de la cellule au signal et la communication intercellulaire et il favorise la croissance des poils. L’interaction a lieu au niveau des jonctions entre les cellules épidermiques: à l’extrémité distale, Fz s’associe à la cadhérine Flamingo (Vmi) tandis qu’à l’extrémité proximale, Fmi s’associe à la protéine transmembranaire Van Gogh (Vang). Une interaction jonctionnelle entre ces deux complexes entraîne alors l’association des protéines de signalisation cytoplasmiques Dishvelled (Dsh) et Diego (Dgo) à Fz/Fmi et de Prickled (Pk) à Fmi/Vang. Chez les mutants fz, l’orientation des poils par rapport à leur voisin et à l’organisme est altérée[3].
Structure
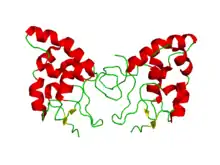
Fz est une protéine comportant 7 domaines transmembranaires (TM). Elle contient aussi des domaines extracellulaires et cytoplasmiques chargés de la transmission et de l’interprétation des informations polaires. Les protéines Frizzled contiennent un domaine riche en cystéine qui est conservé dans différentes protéines, y compris plusieurs récepteurs à activité tyrosine kinase. Sa structure cristalline est connue: elle est essentiellement composée d’hélices alpha avec 5 ponts disulfures entre dix cystéines.
Les protéines et les gènes Frizzled ont été identifiés chez de nombreux animaux, depuis les éponges jusqu’à l’homme[2]. Chez l’homme, dix récepteurs Frizzled sont connus: Frizzled-1 (FZD1 (en)), FZD2 (en), FZD3 (en), FZD4 (en), FZD5 (en), FZD6 (en), FZD7 (en), FZD8 (en), FZD9 (en), FZD10 (en).
Un anticorps monoclonal ciblant cinq de ces récepteurs est actuellement en cours de développement pour le traitement de différents cancers sous le nom de Vantictumab (en).
Références
- PDB: 1IJY; Dann CE, Hsieh JC, Rattner A, Sharma D, Nathans J, Leahy DJ (July 2001). "Insights into Wnt binding and signalling from the structures of two Frizzled cysteine-rich domains". Nature. 412(6842): 86–90. doi:10.1038/35083601. .
- Huang HC, Klein PS (2004). "The Frizzled family: receptors for multiple signal transduction pathways". Genome Biol. 5 (7): 234. doi:10.1186/gb-2004-5-7-234. PMC 463283. .
- Lewis Wolpert, Cheryll Tickle, Alfonso Martinez Arias: «Biologie du développement: les grands principes», page 88, Dunod, le 16 août 2017. (ISBN 9782100757732)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Frizzled » (voir la liste des auteurs).
- Portail de la biologie cellulaire et moléculaire