Ganglion sentinelle
Le ganglion sentinelle est le premier ganglion lymphatique ou groupe de ganglion recevant la lymphe drainée d'une région où l'on suspecte la présence d'un cancer.
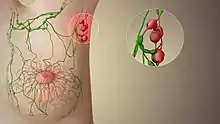
La procédure du ganglion sentinelle est l'indentification, le prélèvement et l'analyse du ganglion sentinelle d'une tumeur donnée[1].
Physiopathologie
Certains cancers ont une évolution stéréotypée, avec une phase primaire de prolifération vers les ganglions régionaux, puis vers des ganglions plus lointains, puisque le drainage lymphatique est unidirectionnel.
C'est pourquoi certains cancers prolifèrent localement de manière prévisible: les cellules tumorales atteindront le premier relais ganglionnaire avant d'envahir d'autre parties du corps.
La procédure du ganglion sentinelle consiste à déterminer si le premier relais ganglionnaire est envahi par les cellules cancéreuses ou non. Si le ganglion sentinelle est sain, alors il est probable que le cancer soit encore localisé, et que le reste du corps en soit encore indemne. Cette approche est notamment utilisée dans le cas du cancer du sein et du mélanome[2].
Méthodes
.jpg.webp)
Le concept du ganglion sentinelle est à la base de la procédure du ganglion sentinelle. Cette procédure faisant partie du bilan d'extension, est utilisée pour évaluer la gravité du cancer, car l'envahissement ganglionaire est un facteur pronostique majeur en cancérologie. Elle peut être également importante pour guider le chirurgien lors de l'opération[3].
Techniques de marquage
Plusieurs méthodes sont utilisées pour repérer les ganglions sentinelles, dans tous les cas un produit est injecté à proximité de la tumeur, dans le but qu'il migre vers le premier relais ganglionnaire (ganglion sentinelle) qui sera alors facilement détectable visuellement ou par imagerie.
Certaines méthodes se basent sur l'utilisation de produits radioactifs (faisant donc intervenir un médecin nucléaire) comme la lymphocytographie planaire pré-opératoire avec ou sans TEMP[4],[5], ou la détection per opératoire du ganglion sentinelle par compteur Geiger ou sonde gamma.
D'autres ne font pas intervenir de radioactivité comme la détection visuelle per-opératoire avec colorant bleu.
Procédure
En routine le médecin nucléaire effectue une lymphoscintigraphie, dans laquelle une substance radioactive de faible activité est injectée à proximité de la tumeur. La substance injectée, colloïde de soufre filtré, est marquée avec le radionucléide technétium-99m.
L'imagerie scintigraphique est généralement démarrée dans les 5 minutes suivant l'injection et le ganglion sentinelle (premiers relais ganglionnaire) apparaît dans les 5 min à 1 heure. Ceci se faisant généralement plusieurs heures avant la biopsie chirurgicale voire la veille. Les protocoles varient en fonction des centres et des pays, mais une injection de colorant bleu, à l'endroit de la précédente injection, par le chirurgien avant l'incision peut également être rajoutée à cette procédure[6].
Ensuite, lors de l'opération, le chirurgien a pour rôle de trouver le ganglion sentinelle, ce dernier peut avoir été "marqué" par un harpon percutané préalablement placé par le nucléariste, par un colorant bleu, et/ou peut être repéré par un compteur gamma/Geiger. Ces méthodes n'étant pas mutuellement exclusives.
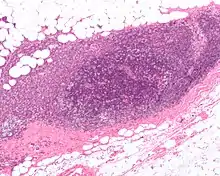
Une fois repéré, le chirurgien procède à une biopsie/exérèse du ou des ganglions sentinelles. Ce prélèvement est envoyé au médecin anatomopathologiste qui souvent, pour guider le reste de la chirurgie, doit rendre des résultats d'orientation diagnostique dans les 30 minutes dans le cadre de ce qu'on appelle une analyse extemporanée. Le but étant de déterminer la présence ou non de cellules cancéreuses
L'intérêt étant qui si l'analyse extemporanée retrouve un cancer, un curage sera effectué dans le même temps, et si l'analyse ne retrouve pas de cancer, un curage ganglionnaire peut être évité en attendant les résultats définitifs.
D'autres analyses anathomopathologiques plus longues seront dans tous les cas effectuées pour être certain du statut (sain ou pathologique) ganglionnaire.
Avantages et inconvénients
La procédure du ganglion sentinelle présente divers avantages. Tout d'abord elle diminue les risques de curage ganglionnaire inutile, et donc de lymphoedème iatrogène, une complication fréquente de cette procédure. Elle permet également de concentrer l'effort d'analyse sur un nombre restreint de ganglions, permettant d'augmenter le nombre de coupes par ganglion et donc de faire une analyse plus fine et plus fiable.
Son principal défaut est le risque de faux négatif. En principe, plus le nombre de ganglions lymphatiques contenant des cellules métastatiques est élevé, plus le pronostic est mauvais. Cependant l'absence de problème dans les ganglions sentinelles n'est pas une garantie totale qu'il n'y ait pas d'autres voies de prolifération de métastases (il existe deux voies de dissémination du cancer ; hématogène (par le sang) et lymphogène (par la lymphe), qui ne sont pas nécessairement liées entre elles[7].
Indications
Ses principales indications sont dans la chirurgie du cancer du sein et du mélanome malin, bien qu'il ait été utilisé dans d'autres types de tumeurs ( cancer du côlon ) avec un certain succès. [8] La technique a été étudiée dans de multiples cancer comme le cancer du pénis, le cancer de la vessie[9],[10], le cancer de la prostate[11],[12],[13], le cancer des testicules [14],[15] et le carcinome à cellules rénales[16],[17] .
Recherche
Cette technique étant multidisciplinaire, divers aspects de la dissémination cancéreuse peuvent être étudiés grâce au ganglion sentinelle, comme la biologie tumorale[18], les mécanismes de dissémination, la transition épithélio-mésenchymateuse, et l'immunologie du cancer[19].
Histoire
Le concept du ganglion sentinelle été décrit pour la première fois par Gould et al. 1960 chez un patient atteint d'un cancer de la glande parotide [20] et a été mise en œuvre cliniquement à grande échelle par Cabanas dans le cancer du pénis. [21] La technique de radiolocalisation du ganglion sentinelle a été co-fondée par James C. Alex, MD, FACS et David N. Krag MD (University of Vermont Medical Center) considérés comme les pionniers de cette méthode pour l'utilisation du mélanome cutané, du sein cancer, cancer de la tête et du cou et carcinome à cellules de Merkel. Des essais de confirmation ont suivi peu de temps après. [22] Des études ont également été menées au Moffitt Cancer Center avec Charles Cox, MD, Cristina Wofter, MD, Douglas Reintgen, MD et James Norman, MD. Suite à la validation de la technique de biopsie du ganglion sentinelle, un certain nombre d'essais contrôlés randomisés ont été lancés pour déterminer si la technique pouvait être utilisée en toute sécurité pour éviter un curage axillaire inutile chez les femmes atteintes d'un cancer du sein précoce. Le premier essai de ce type, dirigé par Umberto Veronesi à l' Institut européen d'oncologie, a montré que les femmes atteintes de tumeurs mammaires de 2 cm ou moins pourraient renoncer en toute sécurité au curage axillaire si leurs ganglions lymphatiques sentinelles se révélaient négatifs. [23] Les avantages comprenaient moins de douleur, une plus grande mobilité du bras et moins d'œdèmes du bras. [24]
Notes et références
- Storino A, Drews RE, Tawa NE, « Malignant Cutaneous Adnexal Tumors and Role of SLNB », Journal of the American College of Surgeons, (DOI 10.1016/j.jamcollsurg.2021.01.019)
- C. Mangas, C. Paradelo, J. Rex, C. Ferrándiz (2008), The Role of Sentinel Lymph Node Biopsy in the Diagnosis and Prognosis of Malignant Melanoma (Review Article) Actas Dermo-Sifiliográficas (English Edition), Vol. 99, N°5, Pages 331-348
- Kumar V, Abbas AK, Fausto N, Aster JC, Robbins & Cotran Pathologic Basis of Disease, Elsevier Health Sciences, , 8th éd. (ISBN 978-1-4377-2015-0), p. 270
- Sherif A, Garske U, de la Torre M, Thörn M, « Hybrid SPECT-CT: an additional technique for sentinel node detection of patients with invasive bladder cancer », European Urology, vol. 50, no 1, , p. 83–91 (PMID 16632191, DOI 10.1016/j.eururo.2006.03.002)
- Leijte JA, Valdés Olmos RA, Nieweg OE, Horenblas S, « Anatomical mapping of lymphatic drainage in penile carcinoma with SPECT-CT: implications for the extent of inguinal lymph node dissection », European Urology, vol. 54, no 4, , p. 885–90 (PMID 18502024, DOI 10.1016/j.eururo.2008.04.094)
- CoPath: Collège français des pathologistes, Anatomie et cytologie pathologiques, Elsevier Masson, , 447 p. (ISBN 978-2-294-75887-4), p. 149 - 150
- Gábor Cserni (2007), Pathological Evaluation of Sentinel Lymph Nodes (Review Article), Surgical Oncology Clinics of North America, vol 16, n°1, janvier 2007, Pages 17-34 (résumé)
- « Frozen section investigation of the sentinel node in malignant melanoma and breast cancer », Annals of Surgical Oncology, vol. 8, no 3, , p. 222–6 (PMID 11314938, DOI 10.1245/aso.2001.8.3.222)
- « Lymphatic mapping and detection of sentinel nodes in patients with bladder cancer », The Journal of Urology, vol. 166, no 3, , p. 812–5 (PMID 11490224, DOI 10.1016/s0022-5347(05)65842-9)
- « Intraoperative sentinel node detection improves nodal staging in invasive bladder cancer », The Journal of Urology, vol. 175, no 1, , p. 84–8; discussion 88–9 (PMID 16406877, DOI 10.1016/S0022-5347(05)00066-2, S2CID 32329157)
- « The sentinel lymph node concept in prostate cancer - first results of gamma probe-guided sentinel lymph node identification », European Urology, vol. 36, no 6, , p. 595–600 (PMID 10559614, DOI 10.1159/000020054, S2CID 46760854)
- « Intensity modulated radiotherapy for high risk prostate cancer based on sentinel node SPECT imaging for target volume definition », BMC Cancer, vol. 5, , p. 91 (PMID 16048656, PMCID 1190164, DOI 10.1186/1471-2407-5-91)
- « Detection of early lymph node metastases in prostate cancer by laparoscopic radioisotope guided sentinel lymph node dissection », The Journal of Urology, vol. 173, no 6, , p. 1943–6 (PMID 15879787, DOI 10.1097/01.ju.0000158159.16314.eb)
- « Lymphatic mapping and gamma probe guided laparoscopic biopsy of sentinel lymph node in patients with clinical stage I testicular tumor », The Journal of Urology, vol. 168, no 4 Pt 1, , p. 1390–5 (PMID 12352400, DOI 10.1016/S0022-5347(05)64456-4)
- « SPECT/CT and a portable gamma-camera for image-guided laparoscopic sentinel node biopsy in testicular cancer », Journal of Nuclear Medicine, vol. 52, no 4, , p. 551–4 (PMID 21421720, DOI 10.2967/jnumed.110.086660)
- « Feasibility of sentinel node detection in renal cell carcinoma: a pilot study », European Journal of Nuclear Medicine and Molecular Imaging, vol. 37, no 6, , p. 1117–23 (PMID 20111964, DOI 10.1007/s00259-009-1359-7, S2CID 61891)
- « Sentinel node detection in renal cell carcinoma. A feasibility study for detection of tumour-draining lymph nodes », BJU International, vol. 109, no 8, , p. 1134–9 (PMID 21883833, DOI 10.1111/j.1464-410X.2011.10444.x)
- Malmström PU, Ren ZP, Sherif A, de la Torre M, Wester K, Thörn M, « Early metastatic progression of bladder carcinoma: molecular profile of primary tumor and sentinel lymph node », The Journal of Urology, vol. 168, no 5, , p. 2240–4 (PMID 12394767, DOI 10.1016/S0022-5347(05)64363-7)
- Marits P, Karlsson M, Sherif A, Garske U, Thörn M, Winqvist O, « Detection of immune responses against urinary bladder cancer in sentinel lymph nodes », European Urology, vol. 49, no 1, , p. 59–70 (PMID 16321468, DOI 10.1016/j.eururo.2005.09.010)
- « Observations on a "sentinel node" in cancer of the parotid », Cancer, vol. 13, , p. 77–8 (PMID 13828575, DOI 10.1002/1097-0142(196001/02)13:1<77::aid-cncr2820130114>3.0.co;2-d)
- « An approach for the treatment of penile carcinoma », Cancer, vol. 39, no 2, , p. 456–66 (PMID 837331, DOI 10.1002/1097-0142(197702)39:2<456::aid-cncr2820390214>3.0.co;2-i)
- « History of sentinel node and validation of the technique », Breast Cancer Research, vol. 3, no 2, , p. 109–12 (PMID 11250756, PMCID 139441, DOI 10.1186/bcr281)
- Veronesi, Umberto et al. (2006) Sentinel-lymph-node biopsy as a staging procedure in breast cancer: update of a randomised controlled study. Lancet Oncol 7:983‒990 doi:10.1016/S1470-2045(06)70947-0
- Veronesi, Umberto et al. (2003) A Randomized Comparison of Sentinel-Node Biopsy with Routine Axillary Dissection in Breast Cancer. N Engl J Med 349:546-553 DOI:10.1056/NEJMoa012782
Voir aussi
Articles connexes
Liens externes
Bibliographie
- (en) Ali-Salaam P, Ariyan S (2000), Lymphatic mapping and sentinel lymph node biopsies ; Clin Plast Surg. ; 27(3):421-9, ix.
- (en) M.J.A.E. Pepels, J.H.M.J. Vestjens, M. de Boer, P. Bult, J.A.A.M. Van Dijck, M. Menke-Pluijmers, P.J. van Diest, G. Borm, V.C.G. Tjan-Heijnen (2013), Models predicting non-sentinel node involvement also predict for regional recurrence in breast cancer patients without axillary treatment ; European Journal of Surgical Oncology (EJSO), Volume 39, Issue 12, , Pages 1351-1357 (résumé)
- (en) Rory O'Connor, Tom Pezier, Clare Schilling, Mark McGurk (2013), The relative cost of sentinel lymph node biopsy in early oral cancer ; Journal of Cranio-Maxillofacial Surgery, Volume 41, Issue 8, December 2013, Pages 721-727 (résumé)
- (en) Alessandro Buda, Cuzzocrea Marco, Carlotta Dolci, Federica Elisei, Romina Baldo, Luca Locatelli, Rodolfo Milani, Cristina Messa (2013), Sentinel node mapping in high risk endometrial cancer after laparoscopic supracervical hysterectomy with morcellation' ; International Journal of Surgery Case Reports, Vol4, n°10, 2013, Pages 809-812.
- Portail de la biologie
- Portail de la médecine
- Portail de l’anatomie