Glycoprotéine de fusion hémagglutinine-estérase
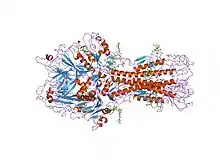
La glycoprotéine de fusion hémagglutinine-estérase (HEF) est une protéine multifonctionnelle de l'enveloppe virale de plusieurs virus, dont le virus de la grippe C, le virus de la grippe D, les coronavirus et les torovirus (en)[1],[2]. Elle est indispensable à l'infectivité (en) de ces virus et fonctionne en reconnaissant des récepteurs transmembranaires, ce qui permet la fusion de l'enveloppe virale avec la membrane plasmique de la cellule hôte et la destruction des récepteurs lors de l'infection de la cellule. Le domaine hémagglutinine de la protéine HEF est responsable de la reconnaissance du récepteur et de la fusion des membranes. Ce domaine ressemble beaucoup à l'hémagglutinine des virus de la grippe A et de la grippe B hormis le fait qu'il se lie à l'acide 9-O-acétylsialique. Le domaine estérase de la protéine HEF est responsable de la destruction du récepteur, réaction réalisée par la neuraminidase chez les virus de la grippe A et de la grippe B. La structure du domaine neuraminidase est semblable à celle de l'estérase de Streptomyces scabies (en) ainsi qu'à des enzymes de type acétylhydrolase, thioestérase I et rhamnogalacturonane acétylestérase (en).
| Pfam | PF02710 |
|---|---|
| InterPro | IPR003860 |
| SCOP | 1flc |
| SUPERFAMILY | 1flc |
La protéine HEF doit être clivée par des protéases de type trypsine de la cellule hôte afin de libérer deux peptides notés HEF1 et HEF2 qui rendent le virus infectieux. L'extrémité N-terminale du peptide HEF2 intervient dans la fusion de l'enveloppe virale avec la membrane plasmique de la cellule hôte, ce qui déclenche l'infection.
La protéine HEF est un trimère dont chaque monomère est constitué de trois domaines : une tige allongée intervenant dans la fusion des membranes, un domaine estérase, et un domaine de liaison au récepteur, ces deux derniers ayant une ressemblance avec l'hémagglutinine du virus de la grippe A. Deux de ces trois domaines sont constitués de séquences non contiguës : le domaine hémagglutinine de liaison au récepteur est inséré dans une boucle à la surface du domaine estérase, et le domaine estérase est inséré dans une boucle à la surface de la tige de l'hémagglutinine.
Notes et références
- (en) Peter B. Rosenthal, Xiaodong Zhang, Frank Formanowski, Wolfgang Fitz, Chi-Huey Wong, Herbert Meier-Ewert, John J. Skehel et Don C. Wiley, « Structure of the haemagglutinin-esterase-fusion glycoprotein of influenza C virus », Nature, vol. 396, no 6706, , p. 92-96 (PMID 09817207, DOI 10.1038/23974, Bibcode 1998Natur.396...92R, lire en ligne)
- (en) Raoul J. de Groot, « Structure, function and evolution of the hemagglutinin-esterase proteins of corona- and toroviruses », Glycoconjugate Journal, vol. 23, nos 1-2, , p. 59-72 (PMID 16575523, DOI 10.1007/s10719-006-5438-8, lire en ligne)
- Portail de la biochimie